NMDA-receptoren: de poortwachters van het zenuwstelsel

Robert van Esch MSc.
PsychoNeuroImmunoloog
N-Methyl-D-Aspartate receptoren (NMDA) zijn glutamaat georiënteerde communicatie- kanalen, die een belangrijke rol vervullen bij het metabolisme van ons centrale zenuwstelsel. NMDA kunnen functioneren als poortwachters op de zenuwcellen. Overmatige expressie en verstoorde functionaliteit worden geassocieerd met talloze neurologische afwijkingen en ziektebeelden. Zo kan hypofunctie resulteren in afname van het cognitief functioneren, terwijl hyperstimulatie toxiciteit en neurodegeneratie kan veroorzaken. Daarom zijn NMDA belangrijke therapeutische doelen bij neurologische ziektebeelden, zoals hersenbloedingen, depressie, epilepsie en schizofrenie. De meeste farmaceutica gericht op beïnvloeding van NMDA hebben beperkt effect en vaak onverwachte of ongewenste bijwerkingen.
NMDA fungeren als receptoren voor stimulerende neurotransmitters binnen het centrale zenuwstelsel en zijn cruciaal voor de regulatie van vegetatieve processen, cognitieve ontwikkeling en neuroplasticiteit. De receptor is overvloedig aanwezig in de cortex, de basale ganglia, op de gevoelszenuwen van het zenuwstelsel en wordt ook aangetroffen op tal van perifere locaties. NMDA zijn primair bestemd voor het aminozuur glutamaat (glutaminezuur), dat behoort tot de meest aanwezige moleculen in de hersenen. De receptor is gewoonlijk geblokkeerd door magnesium (Mg2+) en zink (Zn2+)-ionen. Positieve geladen ionen stromen niet direct het neuron in wanneer glutamaat aan de receptor bindt. Dit gebeurt alleen indien de Mg2+ en Zn2+ worden verwijderd door een stijging van de lading van het membraanpotentiaal, dat normaal een negatieve lading heeft. Het openen van de receptor veroorzaakt vervolgens een instroom van ionen. Ionenpompen in de cel verwijderen een aantal positieve ionen om te voorkomen dat de elektrische lading in de cel te snel stijgt. Deze ionenpompen werken echter alleen als voldoende energie in de cel aanwezig is. Vanwege de activiteit van de ionenpompen is voortdurend stimulans op de NMDA nodig, voordat de cellading dusdanig stijgt dat de primaire blokkade met Mg2+ uit de NMDA wordt verwijderd en kalium (K+) de cel uitstroomt. Zodra Mg2+ is verwijderd, stromen calcium (Ca2+) en natrium (Na+) via de NMDA de cel in en deze opent zich hiermee volledig voor glutamaat. NMDA zijn belangrijk omdat ze de mogelijkheid bieden grote hoeveelheden Ca2+ de neuronen in te sluizen en als poortwachter te fungeren.
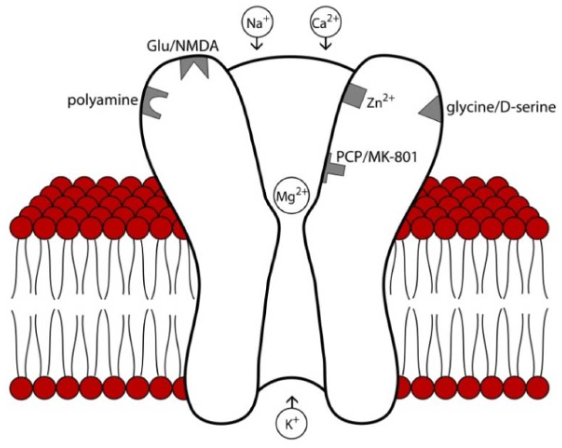
NMDA receptor
Tomek SE et al. Pharmaceuticals 6: 251-268, 2013
De NMDA-paradox
NMDA worden aangetroffen bij synaptische spleten en op externe of extra-synaptische locaties, zoals op de membranen van dendrieten, axonen en gliacellen. Het aantal synaptische NMDA neemt toe bij de groei van neuronen en hun netwerk, ofschoon een significante hoeveelheid NMDA extra-synaptisch blijft gedurende de rijpingsfase van het brein. Bij onrijpe neuronen in de hippocampus kunnen extra-synaptische NMDA tot wel driekwart uitmaken van het totale aantal NMDA. Uit recente studies blijkt dat de responskwaliteit van NMDA mede afhangt van de receptorlocatie. De destructieve uitwerking van een hyperactieve receptor staan daarbij in scherpe tegenstelling met de waarneming dat neuronen voor hun overleving tevens afhankelijk zijn van de activiteit van synaptische NMDA. Eliminatie van actieve receptoren, bijvoorbeeld ten gevolge van een fysiek trauma, kan grootschalige apoptose veroorzaken van neuronen in ontwikkeling. Bij volwassenen kan receptorblokkade van NMDA, toegepast na een traumatische beschadiging van het brein of als behandeling bij neurodegeneratie, zelfs het verlies van neuronale functionaliteit versterken en de overleving van neuronale verbindingen belemmeren. Kortom, NMDA zijn enerzijds belangrijk voor neuronale overleving en kunnen anderzijds, onder pathologische omstandigheden, neuronen beschadigen en vernietigen.
Ex-NMDA theorie
Lang heeft men verondersteld dat de hoeveelheid glutamaat en de mate van instroom van Ca2+ via de NMDA enkel en alleen verantwoordelijk zijn voor de cellulaire integriteit: fysiologische instroom stimuleert gunstige receptoractiviteit, terwijl overload met glutamaat en Ca2+ de excessieve en schadelijke receptoractiviteit stimuleert. Aan de hand van recenter onderzoek heeft men vervolgens verondersteld dat ook de receptorlocatie van belang kan zijn bij het verschil tussen celdood of cellulaire overleving. Synaptische NMDA kunnen mogelijkerwijs neuroprotectie faciliteren en extra-synaptische juist celdood stimuleren. Volgens deze theorie zal niet per definitie de overstroming met glutamaat of Ca2+-ionen de fatale factor zijn, maar de instroom via de extra-synaptische NMDA (‘ex-NMDA’). Daarbij blijkt de synaptische receptoractivering voornamelijk gefaseerd te verlopen en de extra-synaptische activiteit synchroon en chronisch met een andere intracellulaire uitwerking. Uit onderzoek is voorts gebleken dat de calciuminstroom bij intensieve activiteit van synaptische NMDA niet alleen door neuronen goed wordt getolereerd, maar ook genetische programmering kan activeren gericht op betere resistentie tegen apoptose en oxidatiegevoeligheid.
Daarentegen is geconstateerd dat de extra-synaptische NMDA mitochondriale disfunctie en celdood kunnen veroorzaken op zichzelf óf mede onder invloed van de activiteit van synaptische NMDA. Uit sommige studieresultaten blijkt dat synaptische NMDA wel indirect betrokken kunnen zijn bij toxiciteit. Mogelijk is de buitenproportionele co-activatie van beide receptorplaatsen de finale opgang naar celdood. De meest recente studies verbeteren desalniettemin het imago van extra-synaptische NMDA. Zo blijken ook deze receptoren cruciaal voor neuronale ontwikkeling, synapsvorming, neuronale migratie en differentiatie. Wetenschappers suggereren dat de glutamaat afhankelijke extra-synaptische activatie een fundamentele rol kan vervullen bij informatieverwerking. Daarnaast stelt men vast bij hersenactiviteit, die plaatsheeft gedurende exploratory behavior, dat extra-synaptische NMDA actief zijn en dat de communicatie tussen synaptische en extra-synaptische receptoren de synaptische functie versterkt. Aldus kan het zijn dat synaptische en extra-synaptische activatie altijd samen gaan, al dan niet pathofysiologisch van aard. De mate van excitotoxiciteit kan mogelijk afhankelijk zijn van de duur en intensiteit van de activatie.
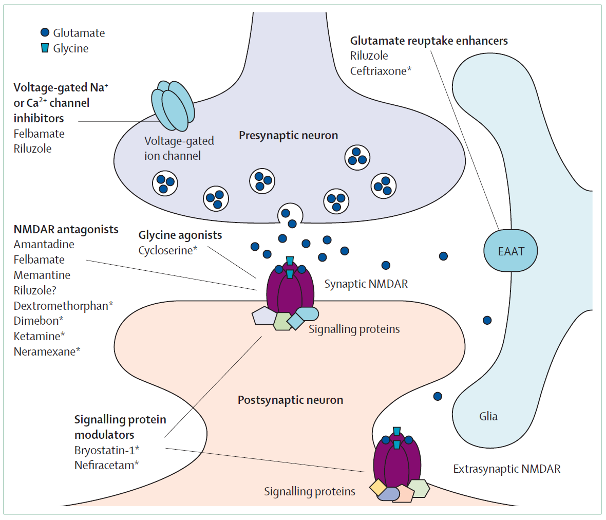
NMDA-receptor gebaseerde behandelstrategie bij neurologische aandoeningen
Kalia LV, Kalia SK, Salter MW. Lancet Neurol 7: 742–55, 2008
Glutamaat-glutamine cyclus
Astrocyten, die behoren tot de neurogliacellen, fungeren als biochemische steuncellen in relatie tot de neuronen en de endotheelcellen die de bloed-hersenbarrière vormen. Zij voorzien de betreffende cellen in brein en ruggenmerg van energiebronnen, handhaven de extracellulaire ionenbalans en spelen een rol bij weefselreparatie. Tevens blijken zij in staat tot de glutamine afhankelijke productie van glutamaat en tot de opname hiervan. Zowel de enzymatische conversie van glutamine naar glutamaat als de enzymatische degradatie van glutamaat naar glutamine gebeurt grotendeels in de astrocyten. Die enzymatische conversies zijn mede afhankelijk van een goed functionerende citroenzuurcyclus en van de aanwezigheid van specifieke micronutriënten, zoals vitamine B6. Zodoende kunnen astrocyten een dominante rol vervullen bij het hersenmetabolisme van glutamaat. Het opnametransport van glutamaat is energieafhankelijk. Gebrek aan energie door bijvoorbeeld ischemie, hypoglycemie of chronische, mitochondriale insufficiëntie kan de circulatie van glutamaat ernstig verstoren. Verstoorde functionaliteit van de neurogliacellen kan extracellulair leiden tot hoge spiegels van glutamaat en dalende spiegels van GABA, wat kan resulteren in toxische effecten van glutamaat in interactie met glutamaatreceptoren, zoals NMDA.
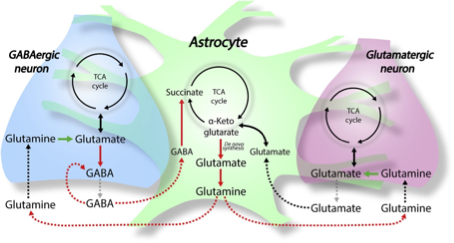
Rol van astrocyten bij regulatie van de glutaminestofwisseling in het centrale zenuwstelsel
Andersen J et al. Neurobiology of Disease 148, 2021
Epiloog
Gezien de complexe en paradoxale functionaliteit van NMDA bij gezondheid en ziekte is het gericht en lokaal kunnen moduleren van de receptor, zonder schade te berokkenen of te verergeren, een zinvolle uitdaging. Binnen deze context is het opvallend dat uit onderzoek is geleken dat neuronen die in een vroeg stadium van hun ontwikkeling worden blootgesteld aan hoge glutamaatspiegels tolerantie kunnen ontwikkelen voor glutamaat en langdurige protectie kunnen genieten. Des te opvallender is vervolgens het inzicht dat moedermelk de eerste en rijkste bron is van glutaminezuur, de directe precursor van glutamaat, waarmee het zich ontwikkelende brein van de pasgeborene in aanraking komt. Althans, dat is zoals de natuur het verlangt! Zowel pre- als postnataal kan reeds een genetische en metabole programmering ontwikkeld worden die de NMDA-stabiliteit en neurogene glutaminestofwisseling kan beïnvloeden. Daarnaast kan in de loop van het leven het stabiliseren en optimaliseren van de mitochondriale functie in het centrale zenuwstelsel van fundamenteel belang zijn. Immers, zonder goed functionerende citroenzuurcyclus ontstaat een risico op verminderde energiebeschikbaarheid voor het energiebehoeftige brein.
Wetenschappelijk webinar
ReThink Foundation organiseert door het jaar heen verschillende wetenschappelijke webinars waaraan u gratis deel kunt nemen. Hierin reiken wij u de theoretische onderbouwing voor de praktische interventies die u aan uw cliënten voor kunt leggen. Deze blog is een verdieping op het opgenomen webinar ‘De metabole competitie voor energie‘. Onder het kopje ‘opleidingen‘ vindt u alle wetenschappelijk webinars en seminars die dit jaar gepland staan of waarvan u de opgenomen versie terug kunt kijken. Je kunt je ook aanmelden voor het komende live webinar: ‘Neurologie/breinfunctioneren‘.
Gonzalez J et al. NMDARs in neurological diseases: a potential therapeutic target. International Journal of Neuroscience 125(5), 2015
Blanke ML and Van Dongen AMJ. Biology of the NMDA Receptor: Activation Mechanisms of the NMDA Receptor. CRC Press/Taylor & Francis, 2009
Pall, M.L. Multiple Chemical Sensitivity: Toxicological and Sensitivity Mechanisms. General, Applied and Systems Toxicology, 2009
Dingledine R et al.The Glutamate Receptor Ion Channels. Pharmacological Reviews 51(1), 1999
Liu Y, Zhang J. Recent development in NMDA receptors. Chin. Med. J. 113 (10): 948–56, 2000
Watkins JC.& Jane DE. The glutamate story. British Journal of Pharmacology 147: 100-108, 2006
Bolton Ch. and Paul C. Glutamate Receptors in Neuroinflammatory Demyelinating Disease. Mediators of
Inflammation: 1-12, volume 2006
Aamodt SM, Constantine-Paton M. The role of neural activity in synaptic development and its implications for adult brain function. Adv Neurol. 79:133–44, 1999
Hardingham GE and Bading H. Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders. Nat Rev Neurosci. 11(10): 682–696, 2010
Hardingham GE, Fukunaga Y, Bading H. Extrasynaptic NMDARs oppose synaptic NMDARs by triggering CREB shut-off and cell death pathways. Nat Neurosci. 5:405–14, 2002
Zhou X, Hollern D, Liao J, Andrechek E, Wang H. NMDA receptor-mediated excitotoxicity depends on the coactivation of synaptic and extrasynaptic receptors. Cell Death Dis. 4, 2013
Zhou X et al. Revisiting the function of extrasynaptic NMDA receptor in excitotoxicity: NMDA receptor and excitotoxicity. Neuroscientist. 21(4): 337–344, 2015
Fiacco TA, Agulhon C, McCarthy KD. Sorting out Astrocyte Physiology from Pharmacology. Annu. Rev. Pharmacol. Toxicol. 49(1): 151–74, 2008
Anderson CM, Swanson RA. Astrocyte glutamate transport: review of properties, regulation and physiological functions. Glia 32(1):1-14, 2000
Schousboe E and Helle S. Waagepetersen. Role of astrocytes in glutamate homeostasis: Implications for excitotoxicity. Neurotoxicity Research 8, Issue 3–4: 221–225, 2005
Friedman LK, Segal M. Early exposure of cultured hippocampal neurons to excitatory amino acids protects from later excitotoxicity. Int J Dev Neurosci. 28:195–205, 2010



