Zoethout: de zoete smaak bij adaptatie

Robert van Esch MSc.
PsychoNeuroImmunoloog
Adaptatie bij stressbelasting is een fenomeen dat ondersteund kan worden met behulp van moleculen uit de natuur. Adaptogenen in de vorm van gestandaardiseerde kruidenextracten kunnen een ‘staat van niet-specifieke weerstand’ tot stand brengen gericht tegen stressoren. Uit studies is gebleken dat adaptogenen bescherming kunnen bieden gericht tegen depressiviteit, angstbeleving, fysieke vermoeidheid en neurologische belasting. Deze werkzaamheid kan deels verlopen via modulerende werking van hormoonassen betrokken bij herstel van de homeostase. De therapeutische toepassing van zoethoutwortelextract (radix Glycyrrhiza glabra) is een voorbeeld van adaptogene beïnvloeding middels hormonale en immunologische modulatie.
Het geslacht Glycyrrhiza behoort tot de Vlinderbloemenfamilie en kent ongeveer twintig soorten. De plant heeft violetgekleurde bloemen, boonachtige vruchten en diepe wortels met oppervlakkige, horizontale vertakkingen. De soorten komen wijdverspreid voor in het zuidwesten van Azië, Australië, China en op het Amerikaanse continent. Ook wordt de plant in beperkte mate aangetroffen rondom de Middellandse zee en in centraal Azië. De meest voorkomende soort is Glycyrrhiza glabra. Zij prefereert een zanderige bodem met goede drainage, zoals aan de oever van een beek of rivier. Haar wortels zijn pas na drie jaar volgroeid en oogstrijp. In het Engels wordt de plant ook liquorice of licorice genoemd. De Grieks-Romeinse arts Dioscorides (ca. 40-90 na Chr.) was de eerste die schreef over glukurrhiza, wat ‘zoete wortel’ betekent in het Grieks. Desalniettemin werd de plant al beschreven in vroegere geschriften afkomstig uit Tibet, China, Babylon, Assyrië en India. Zo wordt het gebruik van yastimadhu of zoethout uitvoerig beschreven in de klassieke teksten van de Ayurvedische geneeskunde. Via Mesopotamië en het Midden-Oosten en door toedoen van Engelse monniken, die deelnamen aan de middeleeuwse kruistochten, verscheen de cultivatie, medicinale kennis en toepassing van zoethout in het westen van Europa. De traditionele toepassing van zoethoutextract was primair gericht op aandoeningen van de bovenste luchtwegen en ontstekingen van maag, darmen en urinewegen. Het extract werd meestal gegeven als drank bij ontstekingen, allergie, luchtwegirritaties en obstipatie en soms toegepast in de vorm van olie bij bijvoorbeeld reumatoïde aandoeningen.
Farmacodynamiek
De wortel is het bestanddeel dat voor therapeutische doeleinden wordt gebruikt. De chemische bestanddelen van zoethoutwortel bestaan uit minsten 400 verschillende moleculen, zoals aminozuren, korte ketenvetzuren, sporenelementen, alkaloïden, glycosiden, essentiële oliën, flavonoïden, chalconen, isoflavonen, triterpenoïde saponinen, sterolen en steroïden. De saponinen, glycosiden en flavonoïden zijn de meest dominante plantstoffen. De flavonoïden, waaronder liquiritine, zijn verantwoordelijk voor de gele kleur van de wortel. Isoliquiritigenine en naringenine zijn de twee belangrijkste flavonoïden in zoethoutwortel. De aanwezige saponinen bestaan voornamelijk uit twee vormen van glycyrrhizine, namelijk 18α-glycyrrhizine en 18β-glycyrrhizine, die beide biologisch actief zijn. De glycoside glycyrrhizine is een mix is van de kalium- en calciumzouten van glycyrrhizinezuur en het aglycon glycyrrhetinezuur. Deze geeft de kenmerkende smaak die tenminste vijftig keer zoeter is dan tafelsuiker. Na consumptie kunnen intestinale bacterieculturen het aglycon vrijmaken, waardoor ook glycyrrhetinezuur metabool actief wordt.
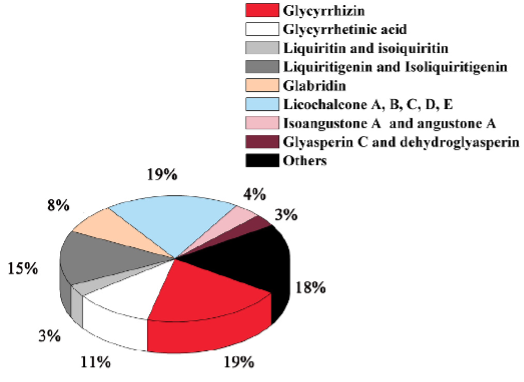
Belangrijkste actieve ingrediënten en hun aandeel in zoethout
Wang C et al. The American Journal of Chinese Medicine Vol. 48(1): 1–29, 2020
Therapeutische effecten
Uit tal van studies is gebleken dat zowel glycyrrhizine (GL) als glycyrrhetinezuur (GA) invloed hebben op het metabolisme van steroïdhormonen. Uit in vitro studies en bij dierproeven is gebleken dat GA en GL de activiteit van de enzymen 5β-Reductase en 11β-hydroxysteroïd hydrogenase kunnen remmen. Deze enzymen, die onderdeel uitmaken van het cytochroom P450, converteren steroïden naar inactieve metabolieten en verlagen bovenal de beschikbaarheid van cortisol. Reeds in 1990 hebben Nederlandse wetenschappers waargenomen dat de orale inname van GA ook bij mensen effect kan hebben op het metabolisme van glucocorticosteroïden. Zij dienden bij tien gezonde vrijwilligers een week lang dagelijks 500 milligram GA toe en constateerden vervolgens dat zowel in plasma als urine de spiegel van vrije cortisol was gestegen en die van het niet actieve metaboliet cortison was gedaald. Dit betekent dat toediening van zoethoutextract de biologische beschikbaarheid van cortisol kan verhogen en/of verlengen en aldus een indirecte ontstekingsremmende werking kan hebben. Aangezien de receptoren voor alle corticoïden, zoals cortisol en aldosteron, behoren tot dezelfde receptorfamilie, kan cortisol zich met dezelfde affiniteit als aldosteron binden aan de receptor voor mineralocorticoïden. Dit kan vervolgens leiden tot de retentie van natrium, de uitscheiding van kalium in de nieren en onderdrukking van het RAA-systeem. Stijging van de bloedruk en vochtretentie kunnen zo het evenredige gevolg zijn van de toename van de cortisolbeschikbaarheid.
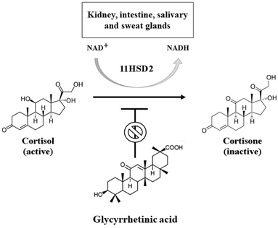
Effect van zoethout op cortisolmetabolisme
Sabbadin C et al. Front. Endocrinol. 10(484), 2019
Immunologische modulatie
Bij beide vormen van GL is bovendien direct effect aangetoond op het immuunsysteem; onder meer remming van de ontstekingsbevorderende prostaglandinesynthese (met name PGE2 en COX2), vermindering van de productie van TNF-α, intracellulaire daling van vrije radicalen en stijging van superoxide dismutase en glutathionperoxidase. Bij GA heeft men eveneens remmend effect vastgesteld de aanwezigheid van op onder andere PGE2, COX2, TNF-α, IL-6, nitrietoxide en vrije radicalen. Naast GL en GA blijken ook de flavonoïden en polyfenolen, zoals glabridine, licoricidine en licochalconen, soortgelijke immunologische impact te hebben. Uit studies in vitro is tenslotte gebleken dat de immunologische impact van GA en GL ook direct impact heeft op de groei en cellulaire pathologie van RNA en DNA virussen, zoals Hepatovirus A en B, Herpes zoster en H.simplex, HIV en CMV.
Middels studies in vivo en in vitro is geconstateerd dat de flavonoïden isoliquiritigenine en naringenine beschikken over de gunstige eigenschap ter promotie van de inductie van T-regulatiecellen (Treg). Deze inductie gebeurt via een dominante factor (FoxP3) die betrokken is bij de ontwikkeling en functionaliteit van perifere Treg. Het effect van zoethoutextract op FoxP3 is specifiek effectief bij Treg en niet bij Th1 of Th17, die betrokken zijn bij cytokineproductie en auto-immunologische expressie. Treg maken onderdeel uit van het cellulaire immuunsysteem en hebben de functie om andere lymfocyten te ‘reguleren’ met als doel afweerreacties te remmen of te onderdrukken. Op deze manier zorgen Treg dat afweerreacties niet uit de hand lopen en wordt voorkomen dat het afweersysteem eigen weefsels of organen aanvalt.
Hormonale modulatie
De impact van GL en GA beperkt zich niet alleen tot de beschikbaarheid van cortisol. Tevens kunnen betreffende moleculen de spiegel van testosteron moduleren. Enerzijds kan de remming van het enzym 5β-reductase gevolgen hebben voor de beschikbaarheid van testosteron. Deze zet namelijk testosteron om in de inactieve vorm 5β-DHT en remming kan aldus de beschikbaarheid van actief testosteron verhogen. Ook hebben onderzoekers geconstateerd dat GA het enzym hydroxysteroid sulfotransferase (SULT2A1) kan beïnvloeden, dat in de bijnierschors mede verantwoordelijk is voor de conjugatie en sulfatie van steroïdhormonen. Men constateerde zowel in vitro als in vivo dat toediening van GA de aanwezigheid van ongeconjugeerd DHEA en deoxycorticosteron deed toenemen. Naast proeven op celculturen werd bij tien gezonde mannelijke en tien gezonde vrouwelijke vrijwilligers in speeksel een hormoonprofiel bepaald na dagelijkse toediening van een preparaat met drie procent zoethoutextract gedurende een week. De wetenschappers zagen vooral bij de mannen een stijging van de aanwezigheid van testosteron, mogelijk door de conversie van precursor DHEA in perifere weefsels. Bij geen van de proeven werd een stijging van de aldosteronspiegel waargenomen.
Anderzijds is uit onderzoek gebleken dat zoethout ook een remmende werking kan hebben op de enzymen, die betrokken zijn bij de conversie van progesteron naar testosteron en van de precursor pregnenolon naar DHEA. Dit betekent dat enzymatische remming door GL en GA eveneens kan leiden tot dalende spiegels van DHEA en testosteron. Mogelijk kan tegelijkertijd de beschikbaarheid toenemen van progesteron en in mindere mate van het metaboliet androstenedion, dat een precursor vormt voor oestrogenen. Aangezien vrouwen vanwege hun genetische programmering grotere producenten zijn van progesteron en minder testosteronafhankelijk zijn dan mannen, is het testosteron verlagende effect van zoethoutextract op hun functioneren mogelijk kleiner. Uit een kleinschalige studie met negen jonge vrouwen bleek desalniettemin dat de dagelijkse inname van tweemaal 3,5 gram zoethoutextract gedurende twee menstruele cycli leidde tot progressieve daling van de serumspiegel van testosteron, hoewel dit nauwelijks fysiologische implicaties had. Tegelijkertijd werden gedurende de testfase geen significante veranderingen waargenomen van de spiegels van progesteron, androstenedion en van cortisol. Dit laatste overigens in tegenstelling tot eerdere studies bij mensen.
Japanse wetenschappers hebben voorts het effect van hoge dosis GL op de testosteronspiegel van mannen bestudeerd. Zij gaven 18 mannelijke diabetespatiënten met chronische hepatitis gedurende minstens een jaar wekelijks 240 tot 525 milligram GL en vergeleken de metabole uitwerking met die van een controlegroep, bestaande uit 21 mannelijke diabetespatiënten. Bij de testgroep bleek na afloop dat de bloedspiegels van totaal en vrij testosteron significant lager waren dan bij de controlegroep. Dit werd door de wetenschappers beschouwd als een gezondheidsrisico en onderbouwd met de waarneming dat bij de testgroep de plaquescore met behulp van ultrasonografie van de halsslagader significant slechter was geworden dan de bij de controlegroep. Opvallend bij deze studie was het langdurige gebruik van hoge doses GL zonder directe indicatie bij een doelgroep met een reeds verstoorde metabolisme. Voorts dient te worden opgemerkt dat zoethoutwortel uit meer bestanddelen bestaat dan alleen GL en dus mogelijk niet exact dezelfde uitwerking heeft als het gebruikte preparaat in de studie. Desalniettemin werd in hetzelfde jaar een studie gepubliceerd waaruit bleek dat ook bij gezonde mannen de serumspiegel van testosteron kan dalen na gebruik van zoethoutextract. In dit geval vond een testosteronspiegeldaling plaats van 26 procent na een week gebruik en tegelijkertijd een stijging van de concentratie 17 β-hydroxysteroid dehydrogenase, dat conversie naar testosteron bewerkstelligt.
Hoewel uit de meeste studies blijkt dat het adaptogene effect van zoethout zich met name manifesteert via enzymmodulatie, blijken bepaalde stoffen in zoethout directe werkzaamheid te hebben op hormonale receptoren. Specifieke chemicaliën kunnen, althans in vitro, oestrogeenreceptoren (ER) moduleren. De ER betreffen de twee typen receptoren die resideren op de celkern en de celmembraan, namelijk ERα en ERβ. De ERα zijn hoofdzakelijk te vinden in het endometrium, de borsten, ovaria en hypothalamus, terwijl de expressie van ERβ grotendeels wordt waargenomen in de ovaria, prostaat, nieren, hersenen, botten, longen, intestinale mucosa, het hart en de endotheelcellen. De overmatige expressie van ERα wordt geassocieerd met de ontwikkeling van hormoongevoelige tumoren. De isoflavonen, glabreen en glabridine, uit zoethout kunnen ER moduleren: glabreen heeft affiniteit voor ERα en in mindere mate voor ERβ, terwijl glabridine antagoneert met ERα en affiniteit heeft voor ERβ. Andere bestanddelen uit zoethout, zoals chalconen, coumarinen en isoflavonoïden, vertonen modulerende activiteit op zowel ERα als ERβ. Met name (iso)liquiritigenine blijkt een agonist te zijn van ERβ, ofschoon met een zwakke affiniteit. Tot op heden zijn in zoethoutwortel tenminste 26 verschillende moleculen geïdentificeerd als mogelijke oestrogeenreceptormodulator, wat zoethout tot een potentiële SERM maakt. Het beschermende effect van glabridine, dat vanwege zijn lipofiele karakter en moleculaire gelijkenis met oestradiol de meeste potente werking heeft, is ongeveer vergelijkbaar met dat van genisteïne en heeft een affiniteit die 10⁴ keer lager is dan oestradiol. Uit onderzoek in vitro op menselijk weefsel is bovendien gebleken dat de gunstige uitwerking van glabridine op hormoongevoelige kankercellen concentratie-afhankelijk is en mogelijk ook andere, cellulaire mechanismen beïnvloedt dan alleen ER: hoe hoger de dosis des te gunstiger de uitwerking de onderzochte celculturen.
Neurologische impact
De adaptogene kwaliteiten van zoethoutextract kunnen eveneens betrekking hebben op het centrale zenuwstelsel. Ten eerste kan verbeterde stressweerbaarheid de schadelijke effecten van langdurige blootstelling van het brein aan vrije radicalen en subklinische ontstekingen beperken. Daarnaast kan de modulerende werking op ER de beschikbaarheid van met name serotonine beïnvloeden. De receptoren voor oestrogenen en serotonine komen namelijk voor in elkanders nabijheid en de activatie van ER beïnvloedt de distributie en status van serotoninereceptoren. De directe werkzaamheid van GL op het centrale zenuwstelsel is bij proefdieren aangetoond. Wetenschappers stelden vast dat een hoge orale toediening van drie milligram GL per kilogram lichaamsgewicht per dag, gedurende zeven dagen, leidde tot een antidepressief effect dat samenhing met adrenerge en dopaminerge activatie. Zij concludeerden dat hoogstwaarschijnlijk sprake is van een remmende werking op het enzym mono-amine oxidase, verwijzend naar een eerdere in vitro studie uit 1991. Uit dierproeven is tevens gebleken dat het molecuul glabridine direct effect kan hebben op de beschikbaarheid van acetylcholine. Men stelde bij muizen vast dat hoge doses van 2 en 4 milligram glabridine per kilogram lichaamsgewicht de activiteit van het enzym cholinesterase remde, waardoor de centrale beschikbaarheid van acetylcholine meer toenam dan bij de controlepopulatie. Desondanks kan de beschikbaarheid van glabridine in het brein belemmerd worden door de beperkte penetratiemogelijkheid die de plantstof heeft door de bloed/hersenbarrière. Hierdoor vermindert de biologische beschikbaarheid in het centrale zenuwstelsel en is hoog doseren noodzakelijk voor direct effect.
Toxicologie en bijwerkingen
Een dagelijkse dosis van één tot tien milligram GL, die overeenkomt met één tot vijf gram zoethoutpoeder, gestandaardiseerd op twee procent GL, kan worden beschouwd als een veilige dosering voor gezonde volwassenen. Hogere doses GL en GA kunnen bij langdurig en ongecontroleerd gebruik leiden tot hypokaliaemie en hypertensie. Dientengevolge kan een conditie ontstaan die pseudoaldosteronisme wordt genoemd met opvallende symptomen, zoals hoofdpijn, moeheid, hoge bloeddruk, vochtophoping en zelfs ernstige hartritmestoornissen. Dit symptoombeeld is individueel bepaald en kan zich al voor doen bij 1.5 gram per dag of pas bij meer dan 200 gram zoethout per dag. Leverfunctiestoornissen, nierfalen, hypertensie, zwangerschap en hartfalen zijn contra-indicaties voor het gebruik van GL en GA. Zoethoutextract kan interactie hebben met diuretica, prednison, hydrocortison en anticonceptiva. De meeste bestanddelen van zoethoutwortel hebben een remmende werking op het cytochroom P450, in het bijzonder op CYP1, CYP2 en CYP3 en hun deelenzymen. De krachtigste werking op het cytochroom, dat behoort tot de eerste fasedetoxificatie, wordt tot stand gebracht door glycyrrhizine.
Conclusies
Het gebruik van zoethout als adaptogeen is aan regels gebonden, zo blijkt. De fysiologische implicaties zijn sterk afhankelijk van dosering en individuele status, zoals geslacht, medicijngebruik en gevoeligheid voor metabolisatie van de biologisch actieve bestanddelen. De metabole uitwerking van zoethout is complex en kan zowel plaatsvinden op het niveau van enzymatische conversie als receptorcommunicatie. De adaptogene manifestatie is driedimensionaal en betreft direct en indirect de bijnier-as, gonaden-as en het immuunsysteem. Mogelijk is het zwaartepunt van deze manifestatie dosis- en geslachtafhankelijk en mede afhankelijk van de metabole verhouding tussen de verschillende plantstoffen, zoals glycyrrhizine (GL) en glycyrrhetinezuur (GA). Veel data over de werkzaamheid is verkregen uit in vitro onderzoek en testen met proefdieren. De klinische studies met mensen zijn in aantal beperkt en gedaan met kleine populaties. Desondanks beidt het gebruik van zoethout kansen en mogelijkheden als alternatief voor reguliere behandelingen van hormonale stoornissen, zoals bijnierinsufficiëntie, auto-immunologische aandoeningen, overgangsklachten en androgeen gerelateerde verstoringen, zoals PCOS.
Wetenschappelijk webinar
ReThink Foundation organiseert elke maand een wetenschappelijk webinar waaraan u gratis deel kunt nemen. Hierin reiken wij u de theoretische onderbouwing voor de praktische interventies die u aan uw cliënten voor kunt leggen. Onder het kopje ‘opleidingen‘ vindt u alle wetenschappelijk webinars en seminars die dit jaar gepland staan of waarvan u de opgenomen versie terug kunt kijken.
Klik hier om je gratis aan te melden voor het webinar ‘Oestrogeendominantie’.
Panossian A and Wikman G. Effects of Adaptogens on the Central Nervous System and the Molecular Mechanisms Associated with Their Stress-Protective Activity. Pharmaceuticals 3: 188-224, 2010
Lee MR. Liquorice (Glycyrrhiza glabra): the journey of the sweet root from Mesopotamia to England. J R Coll Physicians Edinb 48: 378–82, 2018
Yang R, Li W, Yuan B, Ma Y, Zhou S, et al. Simultaneous determination of 18 α-glycyrrhizic acid and 18 β-glycyrrhizic acid in three licorice samples from different origin by HPLC. Chin J Pharm Anal 36: 1065-1071, 2016
Al-Snafi AE. Glycyrrhiza glabra: A phytochemical and pharmacological review IOSR Journal Of Pharmacy 8(6) Version I: 01-17, 2018
Zhang Q. & Ye M. Chemical analysis of the Chinese herbal medicine Gan-Cao (licorice). J Chromatogr A 1216: 1954–69, 2008
Mills S and Bone K. Principles and Practices of Phytotherapy. Churchill Livingstone, 2010
Lin D et al. Effect of Glycyrrhetinic Acid on Pharmacokinetics of Cortisone and Its Metabolite Cortisol in Rats. Journal of Biomedicine and Biotechnology Volume 2012
Mackenzy MA et al. The influence of glycyrrhetinic acid on plasma cortisol and cortisone in healthy young volunteers. J Clin Endocrinol Metab. 1990 Jun;70(6):1637-43
Yang R et al. The anti-inflammatory activity of licorice, a widely used Chinese herb. Pharmaceutical Biology 55(1): 5-18, 2017
Su XS, Chen HM, Wang LH, et al. Clinical and laboratory observation on the effect of glycyrrhizin in acute and chronic viral hepatitis. J Tradit Chin Med 4: 127-132, 1984
Baba M, Shigeta S. Antiviral activity of glycyrrhizin against Varicella-zoster virus in vitro. Antiviral Res 7: 99-107, 1987
Ito M, Sato A, Hirabayashi K, et al. Mechanism of inhibitory effect of glycyrrhizin on replication of human immunodeficiency virus (HIV). Antiviral Res 10: 289-298, 1988
Pompei R, Flore O, Marccialis MA, et al. Glycyrrhizic acid inhibits virus growth and inactivates virus particles. Nature 281: 689-690, 1979
Guo, A. et al. Promotion of regulatory T cell induction by immunomodulatory herbal medicine licorice and its two constituents. Sci. Rep. 5(14046), 2015
E.A.S. Al-Dujaili, C.J. Kenyon, M.R. Nicol, J.I. Mason. Liquorice and glycyrrhetinic acid increase DHEA and deoxycorticosterone levels by inhibiting adrenal SULT2A1 activity. Molecular and Cellular Endocrinology, Elsevier 336 (1-2), 102, 2011
Russell DW, Wilson JD. Steroid 5α-reductase: two genes/two enzymes. Ann Rev Biochem. 63:25–61, 1994
Armanini D et al. Licorice consumption and serum testosterone in healthy man. Exp Clin Endocrinol Diabetes 111(6): 341-3, 2003
Armanini D et al. Licorice reduces serum testosterone in healthy women. Steroids. 69(11-12): 763-6, 2004
Fukui M et al. Glycyrrhizin and Serum Testosterone Concentrations in Male Patients With Type 2 Diabetes. Diabetes Care 26(10), 2003
Armanini D et al. Licorice consumption and serum testosterone in healthy man. Exp Clin Endocrinol Diabetes. 111(6): 341-3, 2003
Powers CN, Setzer WN. A molecular docking study of phytochemical estrogen mimics from dietary herbal supplements. In Silico Pharmacology 3:4, 2015
Simons R et al. Agonistic and antagonistic estrogens in licorice root. Anal Bioanal Chem 401: 305–313, 2011
Tamir S et al. Estrogenic and Antiproliferative Properties of Glabridin from Licorice in Human Breast Cancer Cells. Cancer Research 60: 5704–5709, 2000
Dingra D, Sharma A. Evaluation of antidepressant-like activity of glycyrrhizin in mice. Indian J of Pharmacol. 37(6): 390-394, 2005
Hatano T, Fukuda T, Miyase T, Noro T, Okuda T (1991) Phenolic constituents of licorice, part III. Chem Pharm Bull. 39(5): 1238-43, 1991
Cui M, Ming-Zhang Ao, Wei Li , Long-Jiang Yu. Effect of Glabridin from Glycyrrhiza glabra on Learning and Memory in Mice. Planta Med 74(4): 377-380, 2008
Simmler Ch , Pauli GF, and Chen SN. Phytochemistry and Biological Properties of Glabridin. Fitoterapia 0: 160–184, 2013
Glycyrrhiza glabra, Monograph. Alternative Medicine Review 10(3), 2005
Wang C et al. A Comprehensive Review for Phytochemical, Pharmacological and Biosynthesis Studies
on Glycyrrhiza spp. The American Journal of Chinese Medicine Vol. 48(1): 1–29, 2020


