Cellulaire vitaliteit: het spanningsveld in de mitochondria

Robert van Esch MSc.
PsychoNeuroImmunoloog
Mitochondria zijn unieke organellen in de cel. Tussen mitochondria en bacteriën bestaan daarentegen opvallende overeenkomsten met mogelijke wederzijdse interacties. Het adaptatievermogen van mitochondria is van cruciaal belang voor de energiehuishouding en overleving van de cel. De biologische respons gericht op mitochondriële adaptatie wordt mitohormese genoemd. De balans tussen fagocytose en hormese in de mitochondria bepaalt mede langdurende metabole en biochemische veranderingen, die cellulaire veroudering kunnen vertragen en algehele levensduur kunnen verlengen. De impact van vrije radicalen is hierbij van groot belang en staat op gespannen voet met de anti-oxidatieve capaciteit. Epigenetische factoren, zoals fysieke inspanning, calorische inname, micronutriëntenstatus en de inname van plantstoffen bepalen mede de cellulaire vitaliteit.
Vergeleken met alle andere organellen in de cel zijn mitochondria uniek omdat ze hun eigen DNA bevatten, dus gescheiden van het DNA in de celkern. Enkele proteïnen van het mitochondrium worden door eigen ribosomen geproduceerd. De matrix of de ruimte binnen de binnenste membraan waar de citroenzuurcyclus plaatsvindt, bevat tevens het DNA, de mitochondriële ribosomen, het transfer-RNA en verschillende enzymen die nodig zijn voor de programmering van het mitochondriële genoom. Er zijn ongeveer 3000 genen beschikbaar om een mitochondrium te maken. Het mitochondriële DNA codeert maar voor 37 van deze genen. De resterende genen worden gecodeerd in de celkern van de gastheercel en aldaar geproduceerde proteïnen worden naar het mitochondrium getransporteerd. Slechts enkele procenten van de genen die nodig zijn om een mitochondrium te maken zijn toegewezen om ATP te maken. Meer dan 95 procent van de betreffende genen zijn betrokken bij andere functies gebonden aan de speciale taken van de cel waarin het mitochondrium verblijft. Deze taken veranderen naarmate weefsels groeien en zich aanpassen aan de omgeving. Die andere, niet ATP gerelateerde functies zijn innig betrokken bij de meeste belangrijke metabole paden die door de cel gebruikt worden om zijn moleculaire bouwstenen op te bouwen, af te breken of te recyclen. Cellen kunnen zonder mitochondria geen RNA en DNA maken die ze nodig hebben om te groeien en te functioneren.
Interacties met bacteriën
Met haar hypothese Symbiosis in Cell Evolution verklaart Lynn Margulis opvallende overeenkomsten tussen mitochondria en bacteriën. Bij diverse studies op mensen en kleine zoogdieren zijn inmiddels interacties waargenomen tussen microben van het eigen microbioom en mitochondria. Intestinale bacteriën kunnen bijvoorbeeld een belangrijke leverancier zijn van metabolieten die door mitochondria in spierweefsel worden gebruikt voor het stabiliseren van het lokale milieu. Die metabolieten, zoals korte keten vetzuren en lactaat, vormen energiesubstraat voor de mitochondria, opdat zij in staat zijn ATP te produceren. Het genoom van mitochondria blijkt niet alleen te beschikken over genen die zich met energieproductie bezighouden, ook vindt genetische aansturing plaats van de reductie-oxidatie reactie van elektronen en van de ontstekingsgevoeligheid in de cel. Het genoom van het microbioom reguleert mede deze mitochondriële functionaliteit door invloed uit te oefenen op de energieproductie, vrije radicalenproductie, ontstekingsgevoeligheid en transcriptiefactoren betrokken bij de biogenesis van mitochondria. Dit gebeurt in voortdurende interactie met het mitochondriële DNA. De kwaliteit en diversiteit van de microbiotische culturen staan mede onder invloed van de voeding waarmee zij in aanraking komen. Uit dierproeven en steekproeven bij mensen is gebleken dat de intestinale microflora kan veranderen, afhankelijk van het voedselaanbod. Daarbij blijkt een ongunstige verandering van de flora samen te gaan met waargenomen energieverlies, mogelijk te verklaren door een algeheel verminderde functie van de mitochondria.
Aldus kunnen intestinale floraculturen de mitochondriële stofwisseling, feitelijk het energiemetabolisme van de gastheercel, bevorderen of verstoren. Hetzelfde geldt bij de ongewenste productie van toxische metabolieten, zoals waterstofsulfide, dat een remmende werking heeft op de elektrontransportketen in het mitochondrion. En bij het ongunstige effect van antibiotica; vele antibiotica hebben namelijk als primaire doel de aantasting van het ribosomale RNA (rRNA) van de bacterie, waardoor inhibitie van de proteïnesynthese tot stand wordt gebracht. Uit wetenschappelijke waarnemingen is gebleken dat bij mitochondria hetzelfde kan gebeuren na toediening van antibiotica. Mutaties aan het rRNA van het mitochondrium kunnen vervolgens leiden tot verminderde functionaliteit. Aan de andere kant kan de gunstige productie van korte keten vetzuren door bacteriën in de darm, zoals boterzuur, dienen als energiesubstraat in de citroenzuurcyclus van het mitochondrium en als factor voor de synthese van NADH, een donor in de elektronentransportketen.
Water
Evenzo is een cruciale rol weggelegd voor water. Het elektronentransport vormt het laatste deel van de tweetrapslancering bij de productie van ATP in de mitochondria. Deze laatste stap bij de vorming van lichaamsenergie vereist vier waterstofatomen, twee zuurstofatomen en twee elektronen. Feitelijk betreft die stap de beschikbaarheid van tenminste twee watermoleculen, aangezien een watermolecuul immers bestaat uit twee waterstofatomen, een zuurstofatoom en enkele elektronen, die om de atoomkernen circuleren. Bij de productie van lichaamsenergie produceren de energiefabriekjes tevens de ‘afvalstoffen’ kooldioxide en water (!), die worden uitgescheiden als zweet, waterdamp of urine. Tegelijkertijd kan het lichaam de waterstofatomen uit het water gebruiken om deze te binden aan ongebonden zuurstofatomen, die schadelijk zijn voor de cel. Zodoende kan water eveneens dienen als buffer bij de bestrijding van schadelijke stofjes, zoals ongebonden zuurstofatomen. De beweging van water in en uit de energiefabriekjes ligt bovendien ten grondslag aan hun kenmerkende, buitengewone aanpassingsvermogen. Het vermogen van mitochondria om zich aan te passen aan de behoefte van de cel is van cruciaal belang voor de energiehuishouding en signalering van cellen en cruciaal voor de beslissing van een cel om te blijven leven of dood te gaan, ofwel het plaats hebben van mitohormese of mitofagie.
Mitohormese en ROS
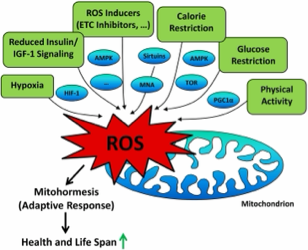
De term mitohormese definieert de biologische respons waarbij de aanwezigheid van low stress in en rondom de mitochondria leidt tot een toename van gezondheid en levensvatbaarheid in de cel. Die mitochondriale stressrespons, geactiveerd door een potentieel schadelijke stimulus, vereist een gecoördineerde dialoog met de celkern en wordt mitonucleaire communicatie genoemd. Dit samenspel, dat in gang wordt gezet door de hormetische respons in mitochondriën, wordt geactiveerd door een verscheidenheid van signalen. De meest relevante signaalstoffen zijn Reactive Oxygen Species (ROS), mitochondriale metabolieten, toxische signalen door verstoorde eiwitsynthese en mitokines. Mitohormese impliceert tevens dat grote hoeveelheden ROS oxidatieve stress kunnen veroorzaken die cytotoxisch is, terwijl een beperkte aanwezigheid van ROS juist adaptatievermogen stimuleert. ROS worden normaliter geproduceerd als bijproduct van het energiemetabolisme in de mitochondria en fungeren in de cel als signaleringsmolecuul betrokken bij cellulaire functie en homeostase.
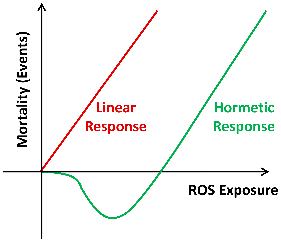
Ristow M and Schmeisser K. Dose-Response 12(2), 2014
Cellen en mitochondria beschikken over anti–oxidatieve mechanismen die de potentieel schadelijke ROS kunnen inactiveren. De enzymen superoxide dismutase (SOD), catalase(CAT) en glutathion peroxidase (GP), peroxiredoxine en thioredoxine fungeren gezamenlijk als vrije radicalenopruimers, waarmee spiegels van ROS proportioneel aanvaardbaar blijven. Het dominante molecuul bij het beperken en repareren van vrije radicalenschade is glutathion. De synthese van glutathion komt tot stand door het samenvoegen van de aminozuren glycine, glutaminezuur en cysteïne, dat, als metaboliet van het homocysteïne–metabolisme, de beperkende factor is bij de synthese. Glutathion bestaat in gereduceerde (GSH) en geoxideerde vorm (GSSG). GSH kan een reducerende elektron overdragen op reactieve deeltjes, zoals enkelvoudige zuurstofatomen en waterstofperoxide, waardoor deze geneutraliseerd worden. Deze interactie leidt vervolgens tot de vorming van GSSG. Voorts fungeert GSH als conjugatiefactor bij het wateroplosbaar maken van toxische verbindingen in de fasedetoxificatie. In gezonde weefsels bestaat tenminste negentig procent van de glutathionvoorraad uit GSH, waarbij de cellulaire gezondheid wordt gekarakteriseerd door een hoge ratio GSH versus GSSG. Een ongunstige ratio, ofwel afname van GSH en stijging van GSSG, is aldus een indicator voor oxidatieve stress. In het lichaam bevinden zich tevens non-enzymatische antioxidanten die onderdeel uitmaken van de stofwisseling, zoals urinezuur en bilirubine. Urinezuur is een bijproduct van het purinemetabolisme en vormt een potentiële antioxidant in bloedplasma. Bij een normale zuurgraad wordt urinezuur omgezet naar uraat. Uit onderzoek is gebleken dat urinezuur een krachtige opruimer kan zijn van vrije radicalen. Uraat blijkt daarnaast een elektrondonor en chelatiefactor voor oxidatiegevoelige ionen, zoals ijzer en koper. Bilirubine is het eindproduct van de haemstofwisseling. Als fysiologische antioxidant is bilirubine in staat peroxyl– en hydroxylradicalen onschadelijk te maken.
Vele situaties kunnen cellulaire stress veroorzaken, waarbij de mitochondria in hun functioneren bedreigd worden. Bijvoorbeeld acuut of chronisch zuurstofgebrek, een acute toename van de behoefte aan ATP, een langdurig verlaagde spiegel van bloedglucose of een combinatie van genoemde factoren kunnen gevaar opleveren voor de mitochondria. Om de cel te informeren van hun verhoogde stressbeleving produceren ze vervolgens meer signaalmoleculen, zoals mTOR, AMPK, Nrf2, HSP, sirtuïns en ROS, om de cel te dwingen tot een moleculaire respons. De signaalmoleculen moduleren genetische expressie en versterken intracellulaire defensiemechanismen, waaronder de anti-oxidatieve capaciteit. Als signaalmolecuul hebben ROS hun nut, echter alleen in hanteerbare hoeveelheden. Alleen dan kan sprake zijn van hormese: de biologische respons gericht op adaptatie. Deze respons is een niet-lineair fenomeen en omgekeerd evenredig aan de belasting met biologische stressoren en schadelijke stoffen. Dit betekent dat lichaamseigen metabolieten en lichaamsvreemde moleculen in kleine hoeveelheden door de cel kunnen worden ervaren als low stress, waarmee lange-termijn stressresistentie en betere bescherming tegen toekomstige uitdagingen kunnen worden bewerkstelligd.
Ristow M and Schmeisser K. Dose-Response 12(2), 2014
Mitofagie
Naast het stimuleren van de cellulaire anti-oxidatieve capaciteit reguleert mitochondriële stress eveneens cellulaire en mitochondriële autofagie en mitochondriële biogenesis. De nieuwvorming van mitochondria is een bijzonder fenomeen, dat sterk doet denken aan een bacteriële oorsprong. De capaciteit van mitochondria om zichzelf te vermenigvuldigen in respons op gunstige epigenetische omstandigheden is van cruciaal belang voor de vitaliteit van de cel en hiermee voor de gezondheid van het totale organisme. Ook het ‘zelfreinigend’ vermogen van mitochondria maakt onderdeel uit van hun arsenaal aan gunstige eigenschappen.
Autofagie en mitofagie zijn natuurlijke, intelligente processen verantwoordelijk voor de afbraak van cellulaire componenten, waarmee de cel wordt beschermd tegen de opeenhoping van beschadigde en verbruikte biomoleculen. De selectieve verwijdering van beschadigde mitochondria wordt mitofagie genoemd. Verminderde kwaliteit van mitochondria vergroot de toename van oxidatieve stress, activeert ongewenste apoptosesignalen en induceert mogelijke celdood. Normaliter draagt mitofagie bij aan de gezondheid van de cel. Mitofagie controleert de levensduur van mitochondria en voorkomt de accumulatie van disfunctionele exemplaren. Bovendien reguleert mitofagie mede het aantal mitochondria in antwoord op de metabole behoeften van de cel en gedurende cellulaire differentiatie.
Het controleren en optimaliseren van de balans tussen mitofagie en mitohormese kan bijdragen aan langdurende metabole en biochemische veranderingen, die cellulaire veroudering vertragen en de algehele levensduur verlengen. De schijnbaar tegenstijdige rol hierbij wordt ingenomen door epigenetische factoren die het niveau van ROS beïnvloeden. Twee prominente factoren zijn lichaamsbeweging en calorische restrictie, die beide de productie van ROS doen toenemen. De toegenomen energiebehoefte bij lichamelijke activiteit stimuleert het metabolisme in de mitochondria, verhoogt de zuurstofconsumptie en vergroot de productie van ATP in met name de skeletspieren. Deze cascade werkt als fysiologische stressor en vergroot de productie van ROS. De cel reageert vervolgens door mechanismen te activeren die zorgen voor anti-oxidatieve verdediging en schadereparatie. Tevens worden metabole adaptaties geïmplementeerd die zorgen voor betere energiemetabolisme en functionaliteit van de mitochondria. Evenzo kan schaarste aan voedingsstoffen in combinatie met verminderde calorische inname fungeren als fysiologische stressor. Dientengevolge ontstaat eveneens een cascade van vrije radicalen en signaalmoleculen gericht op adaptatie.
Antioxidanten
De tweeledige betrokkenheid van micronutriënten met anti-oxidatieve werkzaamheid is een cruciale factor bij het balanceren tussen fagocytose en adaptatie. Volgens de inmiddels gedateerde theory of aging was het onschadelijk maken van ROS met therapeutische doseringen van exogene antioxidanten (vitaminen, mineralen) een belangrijke interventie bij het tegengaan van vrije radicalenstress en hiermee het afremmen van cellulaire veroudering. Echter, uit klinische studies met hoge doses vitaminen is niet vast te komen te staan dat de verouderingshypothese valide is. Uit meta-analyses van klinische studies bleek zelfs kans op verergering van de cellulaire conditie na interventie. Excessieve inname van antioxidanten kunnen de mitohormese belemmeren en hiermee de cellulaire effecten wegnemen. Suppletie met antioxidanten kan zelfs de voordelen van fysiologische adaptatie na training tenietdoen, wat uiteindelijk kan leiden tot verminderd adaptatievermogen en een grotere vatbaarheid voor vrije radicalenstress. Tegelijkertijd zijn specifieke micronutriënten benodigd als cofactor bij de werkzaamheid van anti-oxidatieve enzymen en kunnen fysiologische spiegels van vitaminen met anti-oxidatieve eigenschappen, zoals vitamine A, C en E, herstelmechanismen optimaliseren en cellulaire bescherming tot stand brengen.

Fytochemicaliën
Hoewel hoge doses vitaminen verstorend kunnen werken, kan voeding met grote hoeveelheid aan antioxidantrijke plantstoffen wel beschermend werken. Ten eerste kunnen groenten en fruit het lichaam voorzien van adequate hoeveelheden vitaminen, mineralen en sporenelementen zonder overdosering. Voorts beschikken zij over plantstoffen of fytochemicaliën, die xenohormese tot stand kunnen brengen: exogene stimulatie van de interne communicatiesignalen betrokken bij de adaptatie bij anti-oxidatieve stress. Anti-oxidatieve enzymen, beschermingsmechanismen en cellulaire GSH-status kunnen worden ondersteund door talrijke fytochemicaliën, afkomstig van paddenstoelen, granen, kruiden en specerijen, wortels en andere plantdelen. Enzymen, zoals SOD, CAT en glutathionperoxidase kunnen gemoduleerd worden door moleculen en metabolieten afkomstig van bijvoorbeeld broccoli, groene theeblad, aardbei, citrusvruchten, bessen, cacao, kaneel, rozemarijn, gember, geelwortel, Rhodiola rosea en Withania somnifera. Voorbeelden van goed op hun werkzaamheid onderzochte polyfenolen zijn resveratrol, quercitine, berberine, apigenine, rutine, sulforafaan, silymarine, gingerolen en curcumine. Belangrijk aansluitend te vermelden is dat bij mensen een bilaterale connectie is aangetoond tussen polyfenolen en het intestinale microbioom. Enerzijds kunnen zij de unieke compositie van het microbioom in de darm moduleren. Anderzijds hangt het klinische effect van polyfenolen mogelijk samen met de functionaliteit van intestinale bacterieculturen, die de polyfenolen kunnen omzetten in biologisch actieve metabolieten. Gezien de communicatie tussen bacteriën en mitochondria ontstaat aldus een driehoeksrelatie tussen het intestinale microbioom, mitochondria en plantstoffen in onze voeding.
Conclusies
Mitohormese verenigt op moleculair niveau een groot aantal levensduur regulerende communicatiewegen. De capaciteit van organismen, waaronder zoogdieren zoals de mens, om hun eigen hormese te activeren en te sturen staat in nauwe interactie met de chemische signalen die ze ontvangen van hun directe omgeving. Dominante epigenetische factoren hierbij zijn voedingswijze en bewegingsintensiteit. De duale functie van vrije radicalen (ROS) en de verwerking van vrije radicalenstress in de mitochondria en in de cel zijn bepalend voor de mate van schade of adaptatie. Optimalisatie van de balans tussen de aanwezigheid van ROS en reparatiecapaciteit vergroot de kans op toename van de mitochondriële en cellulaire vitaliteit. Het nog beter begrijpen van die balans kan een bijdrage leveren aan de verdere ontwikkeling van therapeutische interventies gericht op verbetering van de algehele vitaliteit. Een beloftevolle rol is hierbij weggelegd voor fytochemicaliën die, meer nog dan micronutriënten, over therapeutische potentie blijken te beschikken en via xenohormese de cellulaire vitaliteit positief kunnen beïnvloeden.
Bronnen
Iborra, FJ; Kimura H; Cook, PR. Functional organization of mitochondrial genomes in human cells. BMC Biology. 2(9), 2004
Franco-Obregón A, Gilbert JA. The microbiome-mitochondrion connection: common ancestries, common mechanisms, common goals. mSystems 2(3), 2017
Han B et al. Inside Out–a dialogue between mitochondria and Bacteria. The FEBS Journal 286: 630–641, 2019
Clark A and Mach N. The Crosstalk between the Gut Microbiota and Mitochondria during Exercise. Front. Physiol. 8(319), 2017
Trinchese G, Cavaliere G, Canani RB et al. Human, donkey and cow milk differently affects energy efficiency and inflammatory state by modulating mitochondrial function and gut microbiota. J Nutr Biochem, 2015
Singh R et al. Side effects of antibiotics during bacterial infection: Mitochondria, the main target in host cell.Mitochodrion 16: 50-54, 2014
Saint-Georges-Chaumet Y and Edeas M. Microbiota–mitochondria inter-talk: consequence for
microbiota–host interaction. FEMS Pathogens and Disease 74, 2016
Gena P, Fanelli E, Brenner C, Svelto M, Calamita G. News and views on mitochondrial water transport. Front Biosci. 1(14): 4189-98, 2009
Balla P. Water is an active matrix of life for cell and molecular biology. PNAS 114(51): 13327–13335, 2017
Barcena C et al. Mitohormesis, an Antiaging Paradigm. International Review of Cell and Molecular Biology 340: 35-77, 2018
Schieber M and Chandel NS. ROS Function in Redox Signaling and Oxidative Stress. Curr Biol. 24(10): 453–462, 2014
Sena L and Chandel NS. Physiological roles of mitochondrial reactive oxygen species. Mol Cell. 26; 48(2): 158–167, 2012
Owen JB, Butterfield AD. Measurement of oxidized/reduced glutathione ratio. Methods Mol Biol. 648: 269-77, 2010
Powers S K and Jackson MJ. Exercise-Induced Oxidative Stress: Cellular Mechanisms and Impact on MuscleForce Production. Physiol Rev 88: 1243–1276, 2008
Zhang J et al. ROS and ROS-Mediated Cellular Signaling. Oxidative Medicine and Cellular Longevit, 2016
Yun J and Finkel T. Mitohormesis. Cell Metabolism 19, 2014
Ristow M, Schmeisser K. Mitohormesis: promoting health and lifespan by increased levels of ROS. Dose-Response 12: 288–341, 2014
Zhang J. Autophagy and mitophagy in cellular damage control. Redox Biology 1: 19–23, 2013
Powers S K and Jackson MJ. Production. Physiol Rev 88: 1243–1276, 2008
Bjelakovic G et al. Mortality in Randomized Trials of Antioxidant Supplements for Primary and SecondaryPrevention. JAMA, 297(8), 2007
Higgins MR et al. Antioxidants and Exercise Performance: With a Focus on Vitamin E and C Supplementation. Int. J. Environ. Res. Public Health 17(8452), 2020
Merry TL and Ristow M. Do antioxidant supplements interfere with skeletal muscle adaptation to exercisetraining? J Physiol 594(18): 5135–5147, 2016
Yahia EM et al. Contribution of Fruits and Vegetables to Human Nutrition and Health. Postharvest Physiologyand Biochemistry of Fruits and Vegetables, 2019
Goñi I and Hernández-Galiot A. Intake of Nutrient and Non-Nutrient Dietary Antioxidants. Contribution of Macromolecular Antioxidant Polyphenols in an Elderly Mediterranean Population. Nutrients 11(2165), 2019
Dogan Comert E and Gokmen V. Antioxidants Bound to an Insoluble Food Matrix: Their Analysis, Regeneration Behavior and Physiological Importance. Comprehensive Reviewsin Food Science and Food Safety 16, 2017
Zafra-Stone S et al. Berry anthocyanins as novel antioxidants in human health and disease prevention. Mol. Nutr. Food Res. 51: 675 – 683, 2007
Fraga CG et al. The effects of polyphenols and other bioactives on human health. Food Funct. 10(514), 2019
Espin JC et al. The gut microbiota: A key factor in the therapeutic effects of (poly)phenols. BiochemicalPharmacology 139: 82-93, 2017



