De mitochondria-microbioom connectie

Robert van Esch MSc.
PsychoNeuroImmunoloog
Mitochondria zijn de energiecentrales van de cel. Ze zijn celorganellen, die niet zoals de chromosomen in de celkern zitten, maar daarbuiten in het cytoplasma. Ze zijn cruciaal bij het produceren van lichaamsenergie (ATP). De bacteriële oorsprong van humane mitochondria is evident. Uit wetenschappelijke bevindingen concludeert men namelijk dat directe en indirecte effecten bestaan van endogene bacteriën op de functionaliteit van mitochondria en dat zelfs sprake kan zijn van wederzijdse beïnvloeding.
Mitochondria zijn celorganellen die zich bevinden in het cytoplasma en niet, zoals bijvoorbeeld de chromosomen, in de celkern. Ze zijn cruciaal bij de intracellulaire vetzuuroxidatie en het produceren van ATP via de citroenzuurcyclus en de oxidatieve fosforylatie. De mitochondria variëren in diameter van 0,1 tot 0,5 micrometer en kunnen tot tien micrometer lang worden. Ze hebben een opvallend herkenbare vorm. Een mitochondrion heeft twee membranen, die cristae worden genoemd en waarvan de binnenste sterk geplooid is. Die membranen zijn het startpunt voor enzymen en elektronendragers die verantwoordelijk zijn voor het elektronentransport en de oxidatieve fosforylatie. Beide membranen hebben belangrijke verschillen in hun samenstelling. Het binnenste membraan is niet doorlaatbaar voor ionen en wel permeabel voor zuurstof, koolstofdioxide en water. Verder bevat dit membraan transportproteïnen speciaal voor moleculen die nodig zijn voor de mitochondriële functie in de matrix, zoals ATP, ADP, pyruvaat, calciumionen en fosfaat. Het binnenste membraan bevat ook de proteïnen die de oxidatieve reacties uitvoeren van de ademhalingsketen én van het complex ATP-synthase. Het buitenste membraan bevat een transportproteïne, waardoor de buitenste membraan doorlaatbaar wordt voor de kleinste moleculen. De ruimte tussen de binnenste en buitenste membranen bevat enzymen, die ATP gebruiken om nucleotiden te metaboliseren.
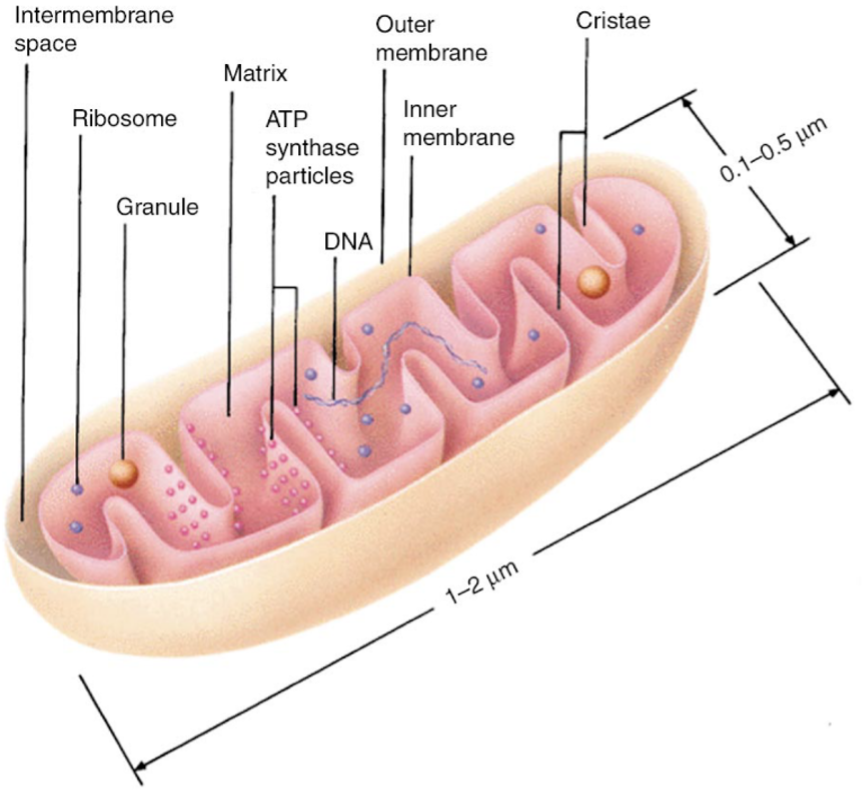
De interne structuur van een mitochondrium
Frey TG and Mannella CA. TIBS 25, 2000
Eigen genoom
Vergeleken met alle andere organellen in de cel zijn mitochondria uniek omdat ze hun eigen DNA bevatten, dus gescheiden van het DNA in de celkern. De matrix of de ruimte binnen de binnenste membraan bevat, naast de enzymen voor de citroenzuurcyclus, tevens het DNA, speciale mitochondriële ribosomen, transfer-RNA en verschillende enzymen die nodig zijn voor de programmering van het mitochondriële genoom. Er zijn ongeveer 3000 genen beschikbaar om een mitochondrion te maken. Het mitochondriële DNA codeert maar voor 37 van deze genen. De resterende genen worden gecodeerd in de celkern van de gastheercel en de resulterende proteïnen worden naar het mitochondrion getransporteerd om aldaar gebruikt te worden. Slechts enkele proteïnen van het mitochondrion worden door ribosomen in het mitochondrion zelf geproduceerd, overeenkomstig zijn eigen DNA.
Slechts enkele procenten van de genen die nodig zijn om een mitochondrion te maken zijn toegewezen om ATP te maken. Meer dan 95 procent van de betreffende genen zijn betrokken bij andere functies gebonden aan de speciale taken van de cel waarin het mitochondrion verblijft. Deze andere, niet ATP gerelateerde functies zijn innig betrokken bij de meeste belangrijke metabole paden die door de cel gebruikt worden om moleculaire bouwstenen op te bouwen, af te breken of te recyclen. Cellen kunnen zonder mitochondria geen RNA en DNA maken die ze nodig hebben om te groeien en te functioneren. Mitochondria bevatten bijvoorbeeld de enzymen van de pyrimidine biosynthese en haemsynthese, die nodig zijn om hemoglobine te maken. Mitochondria zijn ook nodig voor de cholesterolstofwisseling, voor de synthese van steroïdhormonen, ureumproductie en voor de neurotransmitterstofwisseling. Voorts hebben ze een sleutelfunctie bij immunologische regulatie middels hun impact op de calciumstofwisseling, productiecapaciteit van vrije radicalen en afgifte van damage-associated molecular pattern (DAMPs), die als boodschappermoleculen vrijkomen bij cellulaire schade. Die taken veranderen naarmate het lichaam zich ontwikkelt van embryonale fase naar volwassenheid of naarmate weefsels groeien en zich aanpassen aan omgevingsfactoren.
Endosymbiose
De unieke vorm en eigenschappen van mitochondria in vergelijking met andere celorganellen hebben wetenschappers, sinds de ontdekking van de relatie tussen energieproductie en mitochondria, doen zoeken naar verklaringen voor hun oorsprong. Het is onbetwistbaar, gezien de getuigenis van vele fossielen, dat ooit eencellige organismen met weinig of geen intracellulaire organisatie de aarde domineerden. Dit gebeurde hoogstwaarschijnlijk voordat de eukaryoot, waarbij fysieke onderscheid bestaat tussen de celkern en het cellichaam, zijn intrede deed. Die evolutie heeft mogelijk niet alleen via mutaties en selectie plaatsgevonden, maar waarschijnlijk ook via endosymbiose of endosymbiotische genenoverdracht, waarbij genetisch materiaal van de gast wordt overgedragen naar de celkern van de gastheer, en horizontale of laterale genenoverdracht, waarbij genetische uitwisseling tussen organismen plaatsheeft.
De Amerikaanse wetenschapper Lynn Margulis heeft tijdens haar werkzame leven sterke argumenten gepubliceerd voor de hypothese dat eukaryotische cellen ontstaan zijn uit een serie symbiositische interacties. In haar boeken presenteerde zij haar endosymbiotic theory, die gedurende de opvolgende jaren door diverse wetenschappers werd ondersteund met nieuwe ontdekkingen. Zij beschreef voor de eerste keer de morfologische overeenkomst tussen DNA van het mitochondrion en van een bacterie. Voorts beweerde zij dat bij aanvang van de evolutie van leven op aarde algen zuurstof produceerden als een bijproduct van de fotosynthese, waarbij het zuurstof de kans kreeg zich op te bouwen in de atmosfeer. Naast deze algen ontwikkelden zich vervolgens andere bacteriën waarvan sommige over aërobe eigenschappen beschikten. Deze aërobe bacterieculturen werden in de loop der evolutie opgenomen of ingekapseld door anaërobe cellen. Die proto-eukaryote cellen ontwikkelden vervolgens een wederzijds nuttige relatie met de bacteriën. Haar theorie onderbouwde ze met een aantal opvallende observaties. Bacteriën hebben om te beginnen dubbele membranen, net als mitochondria. De samenstelling van deze membranen laat geen overeenkomsten zien met die van de eukaryote cel. Indien mitochondria evolueerden binnen een proto-eukaryote cel, dan zou men verwachten dat de samenstelling van de membranen uit hetzelfde materiaal opgebouwd was. Het blijkt echter dat de lipidensamenstelling van de mitochondriële membranen meer lijkt op die van bacteriële membranen. Ook de sterke plooien van de binnenste membraan zijn opvallend overeenkomstig met die van bacteriën. Volgens Margulis zijn deze plooien aanpassingen met als doel oppervlaktevergroting te bewerkstelligen voor de anti-oxidatieve enzymen, analoog aan de evolutie van de membranen van vele prokaryoten. Verder houden de plooien de verschillende enzymen gescheiden overeenkomstig het gebruik, net als bij bacteriën.
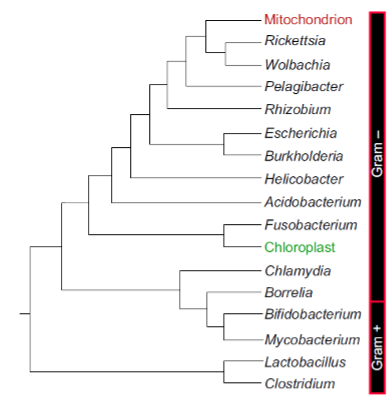
De taxonomische en fylogenetische relatie tussen mitochondria en bacteriën
Han B et al. FEBS Journal 286: 630–641, 2019
Bovendien bevatten mitochondria niet alleen hun eigen DNA, zoals eerder vermeld, maar heeft het DNA morfologische overeenkomst met het DNA van bacteriën. Verder is de verhouding van guanine-cytosine basen in het mitochondriële DNA verhoudingsgewijs hoger, net als bij bacteriën, dan het DNA in de celkern én heeft de ribosomale functie in het mitochondrion meer weg van die van bacteriën in vergelijking met de ribosomen in het cytoplasma. Tenslotte heeft zowel de vorm als dynamiek van het mitochondrion en de wijze van reproductie sterke overeenstemming met die van een bacterie. Uit later onderzoek is voorts gebleken dat mitochondria alleen autofagie gebruiken voor de afbraak van hun cellulaire componenten, wat eveneens plaatsheeft bij bacteriën. Tevens heeft men vastgesteld dat zowel de ribosomen van mitochondria als bacterieculturen gevoelig zijn voor dezelfde antibiotica.
Microbiotische connectie
De theorie van Margulis heeft aan relevantie gewonnen, daar men via latere studies biochemische communicatie heeft waargenomen tussen het microbioom en mitochondria. Het menselijk lichaam bevat een grote hoeveelheid aan diversiteit van microbiotische culturen, waarvan de meerderheid huist in de darmen. De totale aanwezigheid van alle bacteriën in het lichaam vormt het microbioom, dat numeriek een cellulaire meerderheid vormt ten opzichte van de lichaamscellen van de gastheer of -vrouw. De culturen in het maagdarmkanaal bestaan uit miljarden micro-organismen met miljoenen genen. Zij bepalen mede het metabolisme van de gastheer of -vrouw, daar zij voedsel opnemen en verteren, micronutriënten en korte keten vetzuren produceren. Het intestinale microbioom blijkt bijvoorbeeld een belangrijke leverancier van metabolieten die door mitochondria in spierweefsel worden gebruikt voor het stabiliseren van het lokale milieu. Die metabolieten, zoals korte keten vetzuren en lactaat, vormen energiesubstraat voor de mitochondria, opdat zij in staat zijn ATP te produceren. Het genoom van mitochondria blijkt niet alleen te beschikken over genen die zich met energieproductie bezighouden, ook vindt genetische aansturing plaats van de reductie-oxidatie (redox) reactie van elektronen en van de ontstekingsgevoeligheid in de gastheercel. Het genoom van het intestinale microbioom reguleert mede de mitochondriële functionaliteit door invloed uit te oefenen op de energieproductie, vrije radicalenproductie, ontstekingsgevoeligheid en transcriptiefactoren betrokken bij de biogenesis van mitochondria.
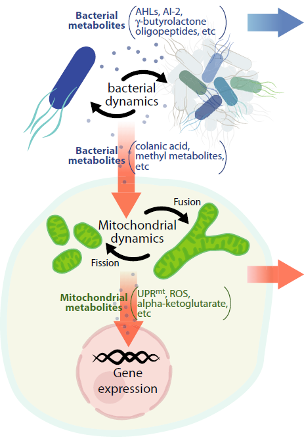
De moleculaire communicatie tussen bacteriën en mitochondria
Han B et al. FEBS Journal 286: 630–641, 2019
De kwaliteit en diversiteit van de microbiotische culturen staan mede onder invloed van de voeding waarmee zij in aanraking komen. Uit dierproeven is gebleken dat de intestinale microflora kan veranderen, afhankelijk van het voedselaanbod. Daarbij blijkt een ongunstige verandering van de flora samen te gaan met waargenomen energieverlies, mogelijk te verklaren door een algeheel verminderde functie van de mitochondria. Aldus kunnen intestinale floraculturen de mitochondriële stofwisseling, feitelijk het energiemetabolisme van de gastheercel, bevorderen of verstoren. Pathogene culturen kunnen bijvoorbeeld stikstofmonoxide (NO) produceren, waarmee direct de productie van aectyl-CoA geremd wordt en indirect de citroenzuurcyclus. Hetzelfde geldt bij de ongewenste productie van toxische metabolieten, zoals waterstofsulfide, dat een remmende werking heeft op de elektrontransportketen in het mitochondrion.
Aan de andere kant kan de gunstige, intestinale productie van korte ketenvetzuren in de citroenzuurcyclus van het mitochondrion worden ingebracht als energiesubstraat en als factor bij de synthese van NADH, een donor in de elektronentransportketen. Uit studies in vitro en bij dierstudies is bijvoorbeeld gebleken dat het korte ketenvetzuur acetaat, dat door de bacteriestam Bacteroides wordt geproduceerd, kan worden gebruikt door mitochondria als energiebron. Tegelijkertijd kan boterzuur, dat door de stam Firmicutes wordt geproduceerd, de biogenese van mitochondria stimuleren middels stimulatie van het AMP-kinase en modulatie van het DNA. Zowel acetaat als boterzuur kunnen bovendien de intracellulaire productie van respectievelijk vrije radicalen en NO afremmen en aldus mitochondriale disfunctie voorkomen. Naast korte ketenvetzuren produceren microbiotische culturen ook secundaire galzuren. Bepaalde anaerobe bacteriën, zoals Clostridia en Bacteroides, verwerken vijf tot tien procent van de galzure zouten uit de enterohepatische kringloop tot metabolieten. Die secundaire galzuren gaan in interactie met mitochondria via beïnvloeding van transcriptiefactoren gericht op het metabolisme van koolhydraten en vetten. Aldus ontstaat een driehoeksrelatie tussen enterohepatische kringloop, intestinale microbioom en systemische energievoorziening.
Conclusies
De unieke positie van het mitochondrion binnen de functionaliteit van de cel hangt mogelijk samen met de evolutie van ons lichaam en is mogelijk van endosymbiotische oorsprong zijn. De wisselwerking van het organel en de cel manifesteert zich op metabole en genetische wijze. Voorts blijken biochemische connecties te bestaan tussen de mitochondria en de mirco-organismen die onderdeel uitmaken van met name het intestinale microbioom. Deze interactie krijgt vorm middels de uitwisseling van substraat en moleculen, die wederzijds metabolische effecten tot stand brengen ten goede of ten kwade de functionaliteit van het mitochondrion en hiermee de uiteindelijke overleving van de gastheer of -vrouw. Gezien de vaststelling dat epigenetische factoren, zoals voeding, impact kunnen hebben op zowel het microbioom als de mitochondria kunnen leefstijlkeuzes hierbij van cruciaal belang zijn. Ofschoon nog veel onderzoek nodig is om de relaties tussen vitaliteit, microbioom en mitochondria verder te kunnen duiden, is het misschien zinvol alvast een zorgzame liefdesrelatie op te bouwen met de eigen intestinale bacterieculturen, die als waarschijnlijke kolonisten van ons microbioom een prominente plek innemen in onze stofwisseling.
Wetenschappelijk webinar
ReThink Foundation organiseert elke maand een wetenschappelijk webinar waaraan je gratis deel kunt nemen. Hierin reiken wij je de theoretische onderbouwing voor de praktische interventies die je aan je cliënten voorlegt. Onder het kopje ‘opleidingen‘ vind je alle wetenschappelijk webinars en seminars die dit jaar gepland staan of waarvan je de opgenomen versie terug kunt kijken.
Herrmann JM, Neupert W. Protein transport into mitochondria. Current opinion in Microbiology 3(2): 210-214, 2000
Mannella CA. Structure and dynamics of the mitochondrial inner membrane cristae. Biochimica et Biophysica Acta. 1763 (5–6): 542–548, 2006
Iborra, FJ; Kimura H; Cook, PR. Functional organization of mitochondrial genomes in human cells. BMC Biology. 2(9), 2004
Dyer, Dexter B and Obar R (editors). The Origin of Eukaryotic Cells, Van Nostrand Reinhold Company Inc., NY. Papers, 1985
Nowack ECM, Melkonian M. Endosymbiotic associations within protists. Phil. Trans. R Soc. Bull 365: 699-712, 2010
Margulis L. Symbiosis in Cell Evolution. W. H. Freeman and Company, San Francisco, 1981
Kalghatgi S, Spina CS, Costello JC, et al. Bactericidal antibiotics induce mitochondrial dysfunction and oxidative damage in mammalian cells. Sci Transl Med 5(192), 2013
Franco-Obregón A, Gilbert JA. The microbiome-mitochondrion connection: common ancestries, common mechanisms, common goals. mSystems 2(3), 2017
Saint-Georges-Chaumet Y and Edeas M. Microbiota–mitochondria inter-talk: consequence for microbiota–host interaction. FEMS Pathogens and Disease 74, 2016
Han B et al. Inside Out – a dialogue between mitochondria and bacteria. FEBS Journal 286: 630–641, 2019
Zhao, L. Genomics: the tale of our other genome. Nature 465, 879–880, 2010
Clark A and Mach N. The Crosstalk between the Gut Microbiota and Mitochondria during Exercise. Front. Physiol. 8(319), 2017
Trinchese G, Cavaliere G, Canani RB et al. Human, donkey and cow milk differently affects energy efficiency and inflammatory state by modulating mitochondrial function and gut microbiota. J Nutr Biochem, 2015
Cardoso SM and Empadinhas N. The Microbiome-Mitochondria Dance in Prodromal Parkinson’s Disease. Front. Physiol. 9(471), 2018
Vezza T et al. Microbiota-Mitochondria Inter-Talk: A Potential Therapeutic Strategy in Obesity and Type 2 Diabetes. Antioxidants 9(848), 2020


