Epigenetica

Robert van Esch MSc.
PsychoNeuroImmunoloog
Onze genen zijn de hardware van het lichaam. Het menselijke genoom bestaat uit meer dan drie miljard gecodeerde letters die liggen opgeslagen in de database van het DNA. Zij kunnen echter niet zelfstandig functioneren of actief worden en zijn afhankelijk van een groot aantal celstructuren, enzymen en intracellulaire stofwisselingsproducten. Genetische activiteit kan alleen optreden als het DNA daartoe in staat wordt gebracht door transcriptiefactoren.
Onder normale omstandigheden heeft het aflezen van DNA een start- en stopsignaal. Ook kunnen genen aan- en uitgeschakeld worden. Daartoe bevinden zich op het DNA verspreide controlepunten die nabijgelegen zones kunnen blokkeren of vrijgeven om gelezen te worden. Deze plekken op het DNA kunnen worden geactiveerd door transcriptiefactoren. Zij kunnen genen activeren of uitzetten en zodra ze verdwijnen, verliezen ze hun invloed op het DNA. De genregulatie is daardoor opvallend flexibel en tegelijkertijd complex. Zo kunnen genen zich relatief makkelijk aanpassen en ontbeert hen de schijnbare mogelijkheid een duurzame identiteit of geheugen te vormen. Het genoom van de mens is te verdelen in coderend en niet-coderende DNA-sequenties. Coderend DNA heeft betrekking op de lettervolgorde die als messenger RNA vertaald kan worden in eiwitten. Dit DNA betreft nog geen twee procent van het genoom. Niet-coderend DNA betreft alle sequenties (ongeveer 98 procent van het genoom) die niet worden gebruikt voor eiwittranscriptie, zoals voor de productie van andere RNA-moleculen. Het duurzame karakter van de genetische programmering wordt gewaarborgd door de software, namelijk het epigenoom. De wisselwerking tussen DNA en transcriptiefactoren is synoniem aan de denkbeeldige dans van genoom en epigenoom, die met hun danspassen de compositie van de biologische programmering bepalen. De epigenetica leert ons dat het epigenoom deze dans leidt, waarvan de choreografie onder andere wordt ingekleurd door acetylatie en methylatie.
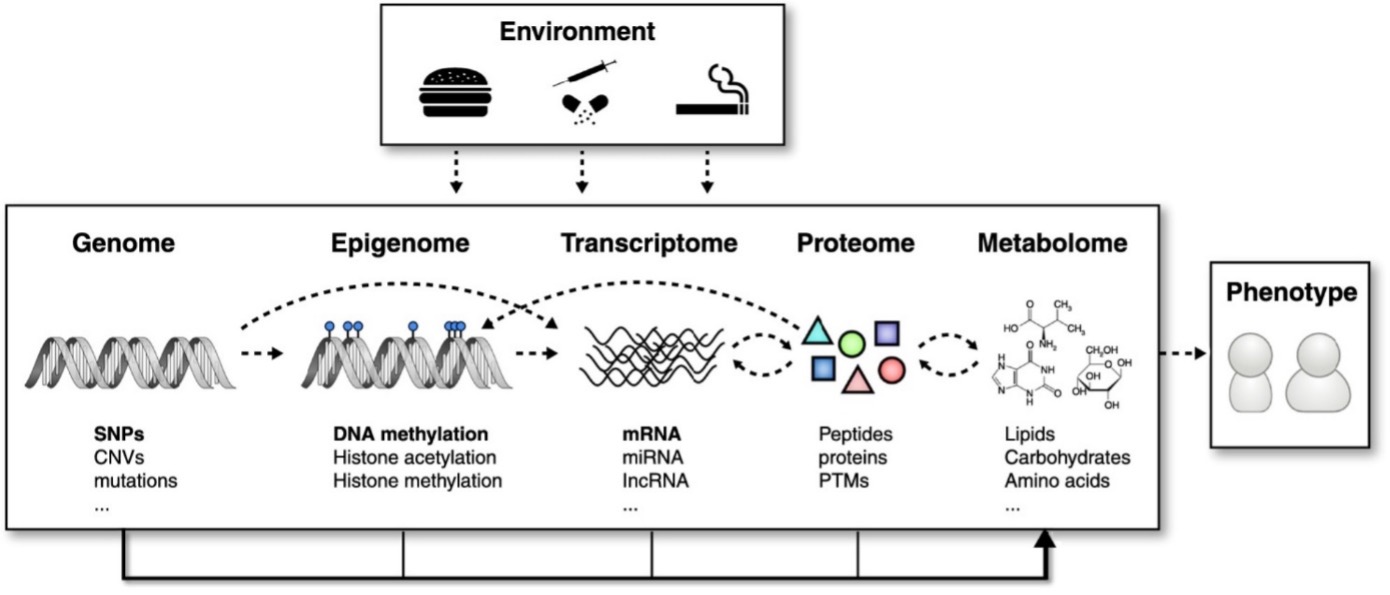
Het epigenoom als schakel bij de unieke genetische expressie
Krumsiek, Bartel and Theis. Current Opinion in Biotechnology 39: 198–206, 2016
OCM
Het one carbon metabolism (OCM) intergreert de epigenetica en micronutriëntenstatus met het cellulaire metabolisme. Hierbij is sprake van twee modulaire eenheden, namelijk de folaatcyclus en methioninecyclus. Diverse micronutriënten en aminozuren verdwijnen in de cycli en worden geconverteerd naar moleculen die een rol gaan spelen in tal van stofwisselingsprocessen, waaronder DNA-modificatie en detoxificatie. OCM verwijst ook wel naar de methylatiecyclus en in deze cyclus worden methylgroepdonoren en methylgroepen met elkander verbonden. Met behulp van cofactoren en enzymatische omzetting kan uit het zwavelhoudende aminozuur methionine het metaboliet s-adenosyl-methionine (SAMe) worden geproduceerd, dat de belangrijkste methylgroepdonor van het lichaam is.
Methylatie is het biologische proces van het gecontroleerd koppelen of doneren van een methylgroep aan eiwitten, enzymen of DNA. Een methylgroep is opgebouwd uit de meest elementaire atomen van het universum, namelijk een koolstofatoom (C) met drie waterstofatomen (Hз). Acetylatie is het biochemisch toevoegen van of moleculair verrijken met een acetylgroep aan een reeds bestaande moleculaire structuur. Een acetylgroep is opgebouwd uit een koolstofatoom (C), zuurstofatoom (O) en een methylgroep (CHз).
Genetische modificatie
In de celkern liggen de DNA-strengen gewikkeld om spoelen. Deze spoelen heten nucleosomen. Een nucleosoom bestaat uit acht kogelvormige eiwitten, die histonen genoemd worden. Het complex van DNA en nucleosomen in de celkern wordt chromatine genoemd en maakt deel uit van het chromosoom. Modificatie of aanpassing van de expressie van het DNA gebeurt middels acetylatie en methylatie van histonen. Histonen beschikken over lange staarten waaraan zich kleine moleculen, zoals acetyl- of methylgroepen, kunnen hechten die samen modulerende activiteiten uitvoeren. Deze histonmodificatie bepaalt of het DNA beschikbaar kan zijn om te worden afgelezen voor genexpressie. Binding van acetylgroepen aan de histonen gebeurt met enzymen genaamd Histone Acetyl Transferases (HAT). Als acetylgroepen zich binden met behulp van HAT, verliest het DNA zijn grip op de histonen. Hierdoor ontstaat ruimte voor moleculen om zich te hechten aan het DNA, waardoor genexpressie mogelijk wordt. Histone Deacetylases (HDAC) verwijderen daarentegen acetylgroepen. Het loskoppelen van de acetylgroep van de histonstaart met behulp van HDAC wordt de-acetylatie genoemd. Hierdoor hecht het DNA zich nauwer aan de histonen, waardoor gene silencing ontstaat.
Via histonen kan ook methylatie plaatsvinden. Specifieke enzymen, de Histone methyltransferases (HMT), hechten dan methylgroepen aan het histon. Hierbij dient SAMe als noodzakelijke methyldonor. Om een gemethyleerde gen actief te maken is het wegnemen van de methylgroep, de-methylatie, dus noodzakelijk. Pas dan zal het gen beschikbaar zijn voor expressie. Methylatie kan tegengesteld of parallel verlopen aan deacetylatie. In beide situaties kan dan sprake zijn van gene silencing.
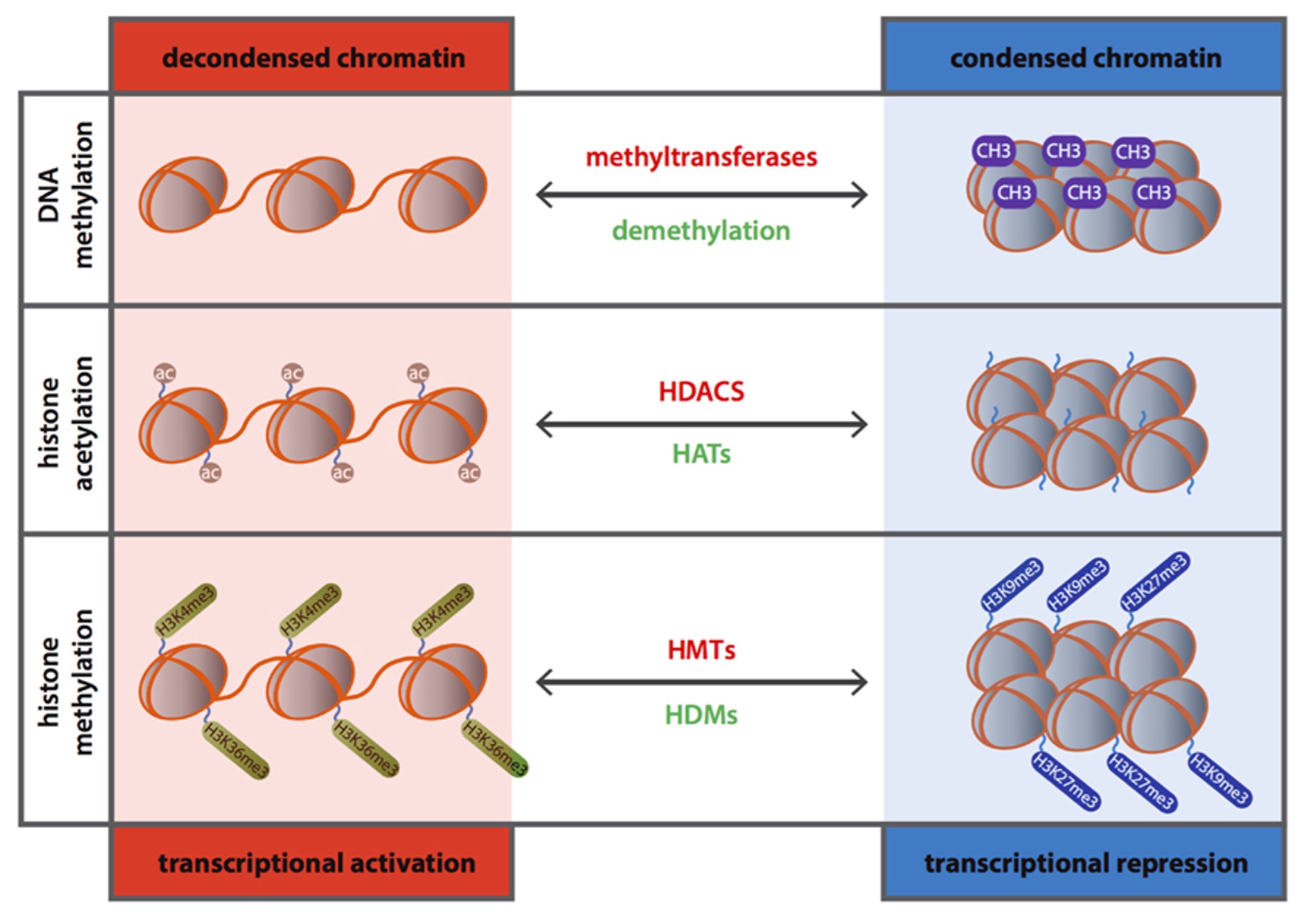
Genetische modificatie met methylgroepen en acetylgroepen
Duygu et al. Frontiers in Genetics 4(219), 2013
Krachtige genetische modificatie kan ook plaatsvinden wanneer het DNA in contact komt met DNA-methyltransferasen (DNMT). Deze speciaal op het DNA gerichte enzymen zijn altijd en alleen ontvankelijk voor de base cytosine. De benodigde methylgroepdonor is opnieuw SAMe! DNMT maken deel uit van een groep enzymen die zorgen voor een epigenetische impact via cytosinemodificatie. Ten Eleven Translocation (TET) enzymen zijn in staat tot demethylatie van het DNA middels het oxideren van 5-methylcytosine. Het metaboliet 5-Hydroxymethylcytosine kan vervolgens actief worden omgevormd tot cytosine door het enzym thymine DNA glycosylase (TDG). Het enzymatische proces, dat aldus bestaat uit methylatie (DNMT), oxidatie of demethylatie (TET) en herstel (TDG) van cytosine is feitelijk een dynamische vorm van DNA-modificatie.
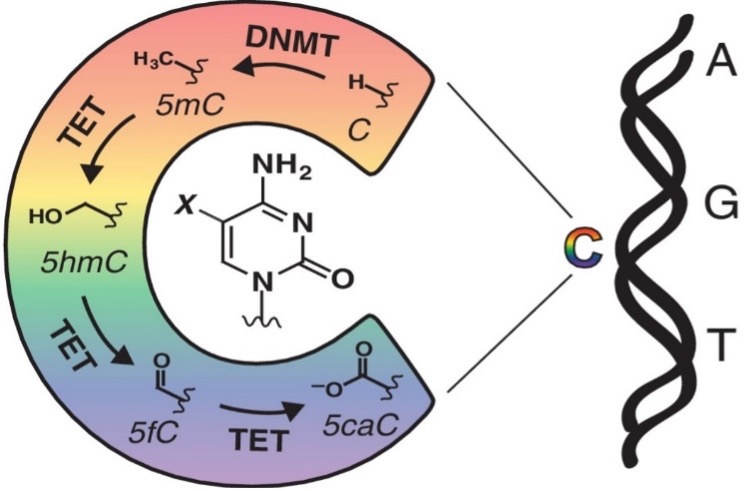
Epigenetische modificatie van de DNA-base cytosine
Liu MY et al. Current Opinion in Chemical Biology 33: 67–73, 2016
Detoxificatie
Methylgroepdonatie is tevens onderdeel van de fase II-detoxificatie. Het OCM produceert tevens zwavelhoudende aminozuren met glutathion als ultieme eindproduct. Glutathion komt in een hoge concentratie in bijna alle cellen voor en behoort tot de belangrijkste antioxidanten in het lichaam. De gereduceerde vorm (GSH) speelt een belangrijke rol in fase II bij de uitscheiding of biologische transformatie middels conjugatie van schadelijke stoffen zoals zware metalen, pesticiden, alcohol, evenals reactieve afbraakproducten die tijdens de fase I van het detoxificatieproces kunnen ontstaan.
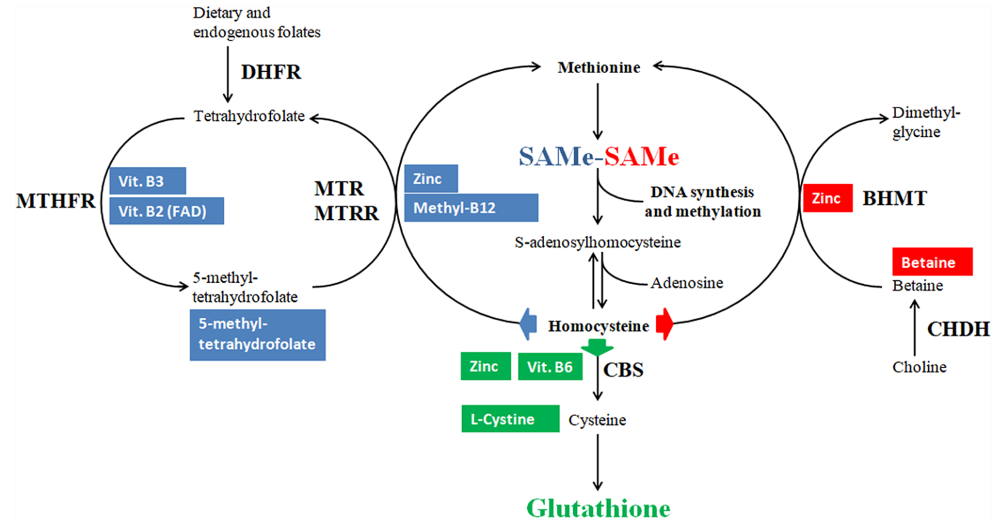
OCM en de productie van glutathion en SAMe
Schiuma N et al. Journal of Endocrinological Investigation 43: 779–786, 2020
Catechol-Oxygen-Methyltransferase (COMT) is ook in de fase II-detoxificatie betrokken bij de methylatie van wateroplosbaar gemaakte metabolieten. COMT komt tot expressie op het endoplasmatisch reticulum (S-COMT) en op de celmembraan (MB-COMT). S-COMT is betrokken bij de metabolisatie van wateroplosbaar gemaakte oestrogeenmetabolieten (2-OH) uit fase I naar de methoxylvorm (2-ME2). Hierbij wordt een methylgroep gebonden aan het metaboliet, waardoor de werkzaamheid (receptoraffiniteit) verandert. MB-COMT is verantwoordelijk voor de inactivatie van de catecholaminen dopamine en noradrenaline. Het enzym koppelt een methylgroep aan de catecholamine, waardoor deze inactief wordt. Aldus constateren we dat bij de conjugatie van toxische stoffen verschillende metabolieten worden geproduceerd afkomstig vanuit het OCM.
Conclusies
De epigenetica spiegelt zich direct in de werkzaamheid van het one carbon metabolism (OCM). Het OCM heeft fysiologische relaties met onder meer de genetische expressie (methylgroepdonatie) en detoxificatie (COMT, glutathionsynthese). Het epigenoom beschikt over diverse mechanismen om het genoom te sturen, waarbij methylgroepen (en methyldonoren) noodzakelijk zijn, zoals histonmodificatie en cytosinemodificatie. Het lichaam heeft nutriënten nodig als enzymatische cofactor én als methyldonor bij de methylatiecyclus. Zonder methyldonoren (SAMe e.a.) heeft het lichaam een toenemend gebrek aan methylgroepen, waardoor genetische programmering op termijn verstoord wordt.
Wetenschappelijk webinar
ReThink Foundation organiseert elke maand een wetenschappelijk webinar waaraan u gratis deel kunt nemen. Hierin reiken wij u de theoretische onderbouwing voor de praktische interventies die u aan uw cliënten voor kunt leggen. Dit blog is een verdieping op het webinar: ‘Methylgroepdonatie: schakel in het one carbon metabolism’. Onder het kopje ‘opleidingen‘ vindt u alle wetenschappelijk webinars en seminars die dit jaar gepland staan of waarvan u de opgenomen versie terug kunt kijken.
McKay JA and Mathers JC. Diet induced epigenetic changes and their implications for Health. Acta Physiol 202: 103–118, 2011
Hardy TM and Tollefsbol TO. Epigenetic diet: impact on the epigenome and cancer. Epigenomics 3(4): 503–518, 2011
Ducker GS and Rabinowitz JD. One-Carbon Metabolism in Health and Disease. Cell Metabolism 25, 2017
Clare CE et al. One-Carbon Metabolism: Linking Nutritional Biochemistry to Epigenetic Programming of Long-Term Development. Annu. Rev. Anim. Biosci. 7: 263–87, 2019
Delage B and Dashwood RH. Dietary Manipulation of Histone Structure and Function. Annu. Rev. Nutr. 28: 347–66, 2008
Perła-Kaján J and Jakubowski H. Dysregulation of Epigenetic Mechanisms of Gene Expression in the Pathologies of Hyperhomocysteinemia. Int. J. Mol. Sci. 20(3140), 2019
Choi SW and Friso S. Epigenetics: A New Bridge between Nutrition and Health. Adv. Nutr. 1: 8–16, 2010
Wu, X., Zhang, Y. TET-mediated active DNA demethylation: mechanism, function and beyond. Nat Rev Genet 18: 517–534, 2017
Kohli RM and Zhang Y. TET enzymes, TDG and the dynamics of DNA demethylation. Nature 502(7472): 472–479, 2013
Liu MY, DeNizio JE, Schutsky EK & Kohli RM. The expanding scope and impact of epigenetic cytosine modifications. Current Opinion in Chemical Biology 33: 67–73, 2016
Yang X and Seto E. HATs and HDACs: from structure, function and regulation to novel strategies for therapy and prevention. Oncogene 26: 5310–5318, 2007
Peter Spork. De Verborgen code – Hoe wij ons DNA sturen. Uitgeverij Veen Magazines, eerste druk 2011
Richard C Francis. Epigenetics. WW Norton & Company, 2011


