Prostaat, eierstokken en epigenetica

Robert van Esch MSc.
PsychoNeuroImmunoloog
Benigne Prostaat Hyperplasie (BPH) of prostaatvergroting en meervoudige ovariumcysten of Polycystic Ovary Syndrome (PCOS) zijn hormonale afwijkingen die steeds vaker voorkomen in gemeenschappen met een zogenoemde westerse levensstijl.
Tegenwoordig krijgt ongeveer vijf tot vijftien procent van de volwassen vrouwen gedurende hun vruchtbare levensfase te maken met PCOS. Van de mannen krijgt ongeveer een kwart BPH als vijftiger en minstens dertig procent als zestigplusser. Uit onderzoek is gebleken dat epigenetische provocatie van genen in combinatie met een permanente verandering van omgevingsfactoren en levensstijl kan bijdragen aan de aanzienlijke toename van BPH en PCOS in de westers georiënteerde samenleving. Zowel bij PCOS als BPH kunnen hormonale afwijkingen in combinatie met een chronisch verhoogde insulinespiegel worden beschouwd als start van de pathofysiologie.
Vanwege een verschillende embryologische ontwikkeling hebben ovarium en prostaat niet dezelfde weefselopbouw, noch dezelfde functie in het voortplantingssysteem. Toch zijn deze organen doelwit voor dezelfde geslachtshormonen, hoewel verstoorde expressie van deze hormonen kan leiden tot verschillende symptomen en klachten. Ofschoon PCOS in omvang en intensiteit kan variëren, is het symptoombeeld consequent: een afwijkende spiegel van testosteron, onregelmatige menstruatie en verminderde vruchtbaarheid. Het is bekend dat BPH ook is gerelateerd aan afwijkende spiegels van geslachtshormonen en dat eveneens sprake is van een consequent symptoombeeld: matige tot ernstige urinewegobstructie (‘moeite met plassen’), vergrote klieromvang en/of verhoogde spiertonus van spieren in de tractus urogenitalis. De rol van vitamine D kan eveneens van betekenis zijn, daar een verminderde beschikbaarheid wordt geassocieerd met een verhoogde ontstekingsgevoeligheid, oxidatieve stress en ongewenste weefselproliferatie. Een lage spiegel van vitamine D en een genetische polymorfisme van de receptor voor vitamine D wordt tevens in verband gebracht met een verstoorde alvleesklierfunctie en falen van de bloedsuikerregulatie, wat nauw samenhangt met de ontwikkeling van PCOS en BPH.
PCOS en (epi)genetica
Volgens de heersende medische opinie zijn afwijkende genetische expressie gericht op de insulineregulatie, productie en omzetting van testosteron en de activiteit van vitamine D betrokken bij de manifestatie van PCOS. Hoewel wetenschappers wel spreken over polymorfisme waarvan bij betreffende genen sprake is, hebben ze geen overtuigend bewijs kunnen aandragen dat de genetische afwijkingen enkel en alleen verantwoordelijk zijn voor de hormonale veranderingen die aan de basis liggen van de pathofysiologie. Noch werden aantoonbare genetische abnormaliteiten geconstateerd bij de insulineregulatie en ontstekingsprocessen die bij het syndroom betrokken zijn. Daarbij hebben wetenschappers de stelling opgeworpen dat mogelijk geen genetische overerving, maar de niet-genetische invloed van omgevingsfactoren verantwoordelijk is voor de ontwikkeling van PCOS. In plaats van erfelijk genetisch falen spreken zij over een ‘genetische variatie’ die als overlevingsmechanisme gedurende de menselijke evolutie is ontwikkeld. Diverse argumenten worden aangedragen om deze hypothese te ondersteunen. Verhoogde testosteronspiegels kunnen bijvoorbeeld gunstig zijn tijdens langdurige perioden van toegenomen externe stressfactoren, daar testosteron assertief gedrag en relatieve onvruchtbaarheid kan promoten. Deze relatieve onvruchtbaarheid kan de interval tussen zwangerschappen verlengen en aldus de geboorte beperken, waardoor de overlevingskans van moeder en nageslacht bij dreigend gevaar of voedselschaarste toeneemt. Functionele afwijking van de glucosespiegel kan bovendien de beschikbaarheid van glucose voor de hersenen verhogen, het vasthouden van lichaamsvocht stimuleren en de bloeddichtheid vergroten, opdat het lichaam beter beschermd wordt bij verwonding of weefselschade. Daarnaast promoot relatieve stijging van de afgifte van insuline gewichtstoename en lichte verhoging van de ontstekingsgevoeligheid, die meestal samengaat met de toename van vetmassa. Zo kan het individu beter beschermd zijn tegen honger en infectie. Aldus hoeft PCOS geen syndroom te zijn maar een genetische aanpassing bij verandering van de dominante levensomstandigheden (bewegingspatroon, menusamenstelling, voedselaanbod). De verschuiving van tijdelijke, functionele aanpassing naar chronische aandoening loopt mogelijk parallel aan de veranderde levensomstandigheden die zich de laatste eeuwen hebben voorgedaan in de huidige samenleving. Leven in een tijdperk van onbegrensde voedselvoorziening en sterk verminderde bewegingsdrang kan de genen betrokken bij insulineregulatie en testosteronproductie dusdanig hebben gestuurd dat omstandigheden buiten het DNA (epigenetica) uiteindelijk zorgen voor de pathofysiologische manifestatie.
BPH en geslachtshormonen
De belangrijkste androgeen bij de genetische en metabole programmering van de prostaat is dihydrotestosteron (DHT), die in de loop van het leven progressief uit testosteron wordt geconverteerd middels het enzym 5α-reductase. DHT heeft een hogere affiniteit voor de androgeenreceptor dan testosteron en interactie met deze receptor veroorzaakt transcriptie van genen onder meer betrokken bij cellulaire proliferatie en functionaliteit en productie van specifieke proteïnen, zoals PSA. Voorts stimuleert DHT diverse groeifactoren betrokken bij proliferatie van prostaatweefsel, zoals epidermale groeifactor (EGF), keratinocyt groeifactor (KGF), insulin like growth factor (IGF) en transforming growth factor-β (TGF-β). Daarnaast kan DHT worden gemetaboliseerd naar het androgene metaboliet 5α-androstane-3β-17β-diol (3βAdiol), dat affiniteit heeft voor de oestrogene receptor ERβ.
Ondanks de algemeen geaccepteerde dominantie van androgenen bij BPH kunnen vrouwelijke geslachtshormonen –oestrogenen– de ontwikkeling van prostaatweefsel eveneens beïnvloeden. Enzymen die androgenen kunnen omzetten in oestradiol zijn namelijk ook in de prostaat aangetroffen. Estradiol-17β (E2) is bij mannen en vrouwen de meeste potente oestrogeen. Bij mannen wordt de meeste E2 gevormd in vetcellen en spieren, ofschoon tot twintig procent van de totale productie kan worden geproduceerd door de Leydigcellen van de testikels. Dit gebeurd door conversie van testosteron middels het enzym aromatase. De lokale productie van E2 in de prostaat heeft voornamelijk lokale werkzaamheid. In de prostaat bevinden zich tevens oestrogene receptoren. Deze receptoren activeren doelgenen, die betrokken zijn bij homeostase, weefselgroei en cellulaire vitaliteit. Receptor ER-α stimuleert voornamelijk anabole processen en kan bij over-activatie ongecontroleerde proliferatie stimuleren, terwijl receptor ER-β moduleert en proliferatie afremt. Receptor ER-β is voornamelijk gelokaliseerd in epitheelcellen van de prostaat, terwijl ER-α vooral wordt aangetroffen in stromale cellen.
Naast E2 en 3βAdiol vertonen ook andere moleculen affiniteit voor oestrogene receptoren, waaronder DHEA en metabolieten afkomstig van exogene oorsprong, zoals plantstoffen en endocrine disrupting chemicals.
Vitamine D en de prostaat
Zowel cellen van de ovaria als die van de prostaat kennen niet alleen receptoren voor dezelfde geslachtshormonen, ook zijn zij ontvankelijk voor corticosteroïden, schildklierhormoon retinol en vitamine D, waarvan de receptoren alle tot dezelfde familie behoren. Prostaatweefsel kan bovendien vitamine Dვ omzetten in de actieve vorm 1,25 dihydoxyvitamine Dვ (1,25Dვ) en beschikt hierbij over de benodigde enzymen. Een (te) lage bloedspiegel van vitamine Dვ kan proliferatie in prostaatcellen stimuleren en apoptose tegengaan. Klinisch onderzoek (in vitro) demonstreert bovendien de relatie tussen een gestegen bloedspiegel van vitamine Dვ en remming van ongunstige celgroei in prostaatweefsel. Onderzoekers hebben in de prostaatcellen eveneens een op vitamine D reagerend gen gevonden, dat gemoduleerd werd in de aanwezigheid van 1,25Dვ. Dit reactieve gen, dat codeert voor mitogen-activated protein kinase (MAPK) type5, was al bekend als stimulator van ontstekingseiwitten, die in grote mate betrokken zijn bij de ontwikkeling en progressie van (ongecontroleerde) celgroei. Aldus kan vitamine D indirect een ontstekingsremmende en controlerende invloed uitoefenen op prostaatweefsel. Bovendien kan een directe, beschermende invloed van 1,25Dვ op prostaatcellen niet uitgesloten worden, daar de receptoren voor vitamine D, androgenen en oestrogenen immers tot dezelfde familie behoren en mogelijk sprake kan zijn van cross talk.
Bloedsuiker en hormonale verhoudingen
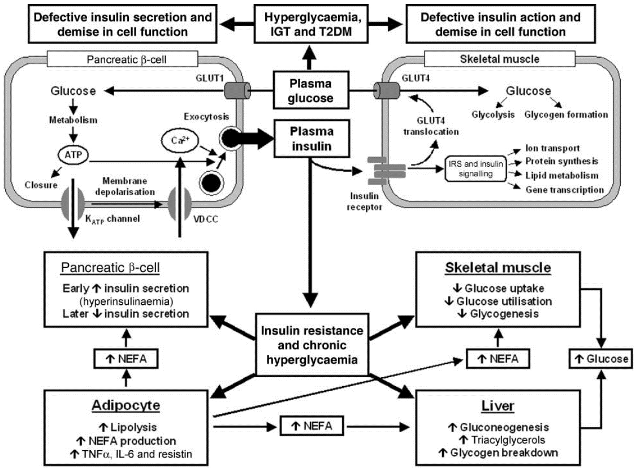
Cellen in de alvleesklier blijken – net als prostaatcellen – eveneens te beschikken over receptoren voor vitamine D en gebrek aan de vitamine kan samenhangen met een verstoorde productie en afgifte van insuline. In ieder geval is een directe, significant verband vastgesteld tussen vitamine D, insulinegevoeligheid en de functie van β-cellen in de alvleesklier, die de insuline produceren. Hoewel 1,25Dვ een rol kan spelen bij de metabole en immunologische status van organen, heeft de aanwezigheid van het metabool syndroom minstens een even grote invloed op het krijgen van prostaatklachten.
Diverse studies zijn gedaan naar de relatie tussen insulineresistentie, hormonale veranderingen en levensstijl. Langdurig verhoogde insulineproductie zorgt op termijn voor een afgenomen insulinegevoeligheid of insulineresistentie, waardoor de alvleesklier nog meer insuline produceert ter compensatie. De afgenomen, intracellulaire gevoeligheid van de glucosereceptor voor de insulinereceptor wordt insulineresistentie of glucose-intolerantie genoemd. De intracellulaire communicatie reageert dan niet of sterk verminderd op een gestegen glucosespiegel. Pathofysiologische insulineresistentie gaat gepaard met de toegenomen aanwezigheid van vrije vetzuren en ontstekingseiwitten in het bloed, wat vaak hoort bij overgewicht en kan samengaan met zowel BPH als PCOS. Deze vicieuze cirkel stimuleert eveneens een verstoorde verhouding tussen testosteron en 17β-oestradiol, waardoor bij sommige vrouwen de spiegel van testosteron relatief kan toenemen en bij mannen juist oestrogene dominantie wordt ontwikkeld. Dit effect wordt versterkt, doordat de genetische expressie en activiteit van het enzym 5α-reductase gestimuleerd worden door androgenen en insuline en door groeifactor IGF-1.
Meerdere, kleinschalige studies met proefpersonen wijzen op een verbetering van de menstruatie, androgene index, vruchtbaarheid en insulineregulatie bij vrouwen met PCOS, nadat zij periodiek waren onderworpen aan een bloedsuiker regulerend dieet, soms gecombineerd met een bewegingsprogramma.
Uit onderzoek blijkt voorts dat de prostaatklier opmerkelijk groter is bij mannen met diabetes type 2, hypertensie, overgewicht, afwijkende cholesterolspiegels en een hoge insulinespiegel. Aangezien chronisch verhoogde bloedsuikerspiegels en chronische insulineresistentie de basis vormen van het Metabool Syndroom en ook diabetes en overgewicht te maken hebben met een verstoorde bloedsuikerregulatie, zal de kwaliteit hiervan van nauw verbonden kunnen zijn met het wel of niet verschijnen van BPH. Aldus ontstaat tevens een relatie tussen bloedsuikerregulatie en prostaatklachten. De WHO definieert het Metabool Syndroom als het verschijnen van een verstoorde bloedsuikerregulatie en twee of meerdere andere verstoringen: hypertensie, overgewicht, verstoorde stofwisseling van bloedvetten en/of nierfunctiestoornissen. Uit een Chinese studie blijkt daarenboven dat niet alleen afwijkende insuline- en glucosespiegels worden geassocieerd met prostaatproblematiek. Aan de hand van data over meerdere jaren van 415 oudere Chinezen heeft men vastgesteld dat tevens afwijkende bloedspiegels van door vetcellen geproduceerde cytokinen (leptine e.a.), CRP, TNF-α, SHBG en testosteron waarneembaar kunnen zijn bij mannen met een vergrote prostaat en klachten aan de lagere urinewegen.
Beweging en voeding
Niet alleen een verstoord metabolisme, maar ook onevenwichtige expressie van het sympatische zenuwstelsel kan betrokken zijn bij de pathofysiologie van chronische prostaatklachten. De chronische productie van adrenaline kan motoreenheden activeren die betrokken zijn bij de spierspanning in urinewegen en prostaat. Overspanning of hypertonie van de betreffende spiergroepen kan de obstructies veroorzaken die meestal bij BPH ervaren worden. Ontspanning of verlaging van de spiertonus door verminderde betrokkenheid van adrenaline kan mogelijk bijdragen aan verbetering van het symptoombeeld. Middels een grootschalig onderzoek onder meer dan 3000 mannen heeft men in de vorige eeuw vastgesteld dat prostaatklachten minder voorkwamen bij mannen die lichamelijk actief waren. De onderzoekers concludeerden dat diverse activiteiten, vooral wandelen, omgekeerd gerelateerd waren aan het gestegen risico op BPH en dat 2 tot 3 uur per week wandelen in een redelijk tempo het meeste verschil maakte. Zij namen ook waar dat dagelijks gebrek aan lichamelijke activiteit onherroepelijk samenging met een hoger risico op prostaatklachten. Desondanks liet dit onderzoek niet duidelijk zien hoe en of alleen het effect van bewegen op het zenuwstelsel verantwoordelijk was voor vermindering van spiertonus in bekken en onderbuik. Bovendien mag de invloed van bewegen op de glucosegevoeligheid niet onderschat worden, aangezien skeletspieren benodigd voor de fysieke inspanning, over de meeste insulinegevoelige glucosereceptoren beschikken die bloedglucoseklaring kunnen laten plaatsvinden.
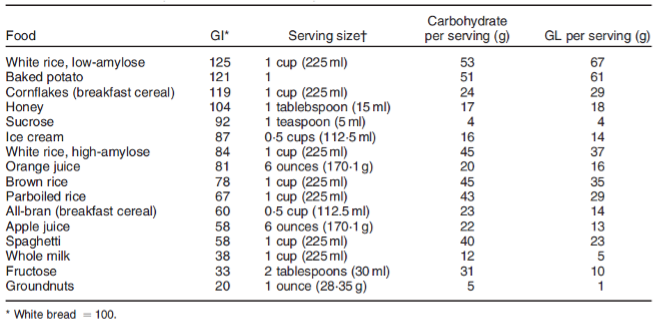
Naast de effecten van fysieke inspanning op de prostaat is ook de invloed van voedingsstoffen onderzocht. Middels diverse onderzoeken heeft men waargenomen dat gemiddelde tot bovengemiddelde consumptie van verse groente omgekeerd evenredig was aan het ontwikkelen van BPH. Vooral hoge inname van voeding rijk aan bètacaroteen (wortels, boerenkool, groene bladgroente), luteïne (o.a. spinazie, andijvie, boerenkool, broccoli), zeaxantine (spinazie, spruiten, broccoli, maïs, sinaasappel) of vitamine C (o.a. aardappelen, spruitjes, broccoli, vers fruit) kan het risico op BPH verlagen. De regelmatige consumptie van Brassicaceae (bloemkool, boerenkool, broccoli, spruitjes, witte kool, Chinese kool, radijs en koolrabi), bepaalde peulvruchten (erwten, bonen, alfalfa), sinaasappels en perziken werd eveneens geassocieerd met risicovermindering, zij het in bescheiden mate. Tevens hebben wetenschappers met een andere studie onder 2820 mannen een aantoonbaar, negatief verband aangetoond tussen de consumptie van meervoudig onverzadigde vetzuren en het risico op de ontwikkeling van prostaatvergroting. Geen significante invloed werd waargenomen bij de consumptie van verzadigde vetzuren, enkelvoudig onverzadigde vetzuren en oliezuur. De inname van zetmeelrijke voeding, zoals wit brood, pasta en rijst, werd daarentegen wel geassocieerd met een toegenomen risico op de ontwikkeling van BPH. Opvallend is dat die producten met niet-resistent zetmeel hoog scoren met hun glycaemische index en dientengevolge nadelige uitwerking hebben op de bloedsuikerregulatie.
Conclusies
Epigenetische expressie gecombineerd met permanente veranderingen van levensomstandigheden kan worden beschouwd als een significante factor bij de toename van geslachtsorgaan gerelateerde ziektebeelden in de westers georiënteerde samenleving. De individuele manifestatie kan samenhangen met exogene invloeden, zoals voedingspatroon en lichamelijke activiteit. Bij zowel BPH als PCOS speelt een afwijkende bloedsuikerregulatie een fundamentele rol in de pathofysiologie. Eventuele voedingsaanpassingen in combinatie met een regelmatig bewegingspatroon kunnen de alvleesklier ontlasten en chronische bloedsuikerverstoringen verminderen. Verbeteringen van de alvleesklierfunctie en de vermindering van insulineresistentie kan bovendien beïnvloed worden door de beschikbaarheid van vitamine Dვ in het lichaam. Aldus kunnen aangepaste voeding, dagelijks bewegen en een optimale spiegel van vitamine Dვ bijdragen aan voorkomen, uitstellen of verbeteren van het symptoombeeld bij endocriene orgaandisfuncties, zoals prostaatvergroting of PCOS.
Nicholson TM and Ricke WA. Androgens and estrogens in benign prostatic hyperplasia: past, present and future. Differentiation. 82(4-5): 184–199, 2011
Dhanasekaran SM et al. Molecular profiling of human prostate tissues: insights into gene expression patterns of prostate development during puberty, The FASEB Journal, 2004
Escobar-Morreale HF, Luque-Ramirez M, San Millán JL. The Molecular-Genetic Basis of Functional Hyperandrogenism & the Polycystic Ovary Syndrome, Endocrine Rev, 26(2): 251-282, 2005
Takase Y, Levesque M, Luu-The V, El-Alfy M, Labrie F, Pelletier G. Expression of Enzymes Involved in Estrogen Metabolism in Human Prostate, Journal of Histochemistry & Cytochemistry 54(8): 911-921, 2006
Nagpal S, Na S, Rathnachalam R. Noncalcemic Actions of Vitamin D Receptor Ligands. Endocrine Reviews 26(5): 662-687, 2005
Chiu KC, Chu A, Go VLW, Saad MF. Hypovitaminosis D is associated with insulin resistance and β-cell dysfunction. American Journal of Clinical Nutrition, 79: 820-825, 2004
Habuchi T et al. Association of Vitamin D Receptor Gene Polymorpism with Prostate Cancer and Benign Prostatic Hyperplasia in a Japanese Population, Cancer Research 60: 305-308, 2000
Zhang W et al. Vitamin D Deficiency as a Potential Marker of Benign Prostatic Hyperplasia. Urology 97: 212–218, 2016
Nonn L, Peng L, Feldman D, Peehl DM. Inhibition of p38 by Vitamin D Reduces Interleukin-6 Production in Normal Prostate Cells via Mitogen-activated Protein Kinase Phosphatase 5: Implications for Prostate Cancer Prevention by Vitamin D. Cancer Research. 66(8): 4516-4524, 2006
Palomer X, Gonzalez-Clemente JM, Blanco-Vaca F, Mauricio D. Role of vitamin D in the pathogenesis of type 2 diabetes mellitus, Diabetes, Obesity and Metabolism 10: 185-197, 2008
McClenaghan NH. Determining the relationship between dietary carbohydrate intake and insulin resistance. Nutrition Research Reviews 18: 222–240, 2005
Cahova M, Vavrinkova H, Kazdova L. Glucose-Fatty Acid Interaction in Skeletal Muscle Tissue in Insulin Resistance, Physiol. Res. 56: 1-15, 2007
Jessen N, Goodyear LJ. Contraction signaling to glucose transport in skeletal muscle, Journal of Applied Physiology 99: 330-337, 2005
Moran LJ et al. Dietary Composition in Restoring Reproductive and Metabolic Physiology, The Journal of Clinical Endocrinology & Metabolism, 88(2): 812-819, 2003
Lim SS, Hutchison SK, Van Ryswyk E, Norman RJ, Teede HJ, Moran LJ. Lifestyle changes in women with polycystic ovary syndrome. Cochrane Database of Systematic Reviews Issue 3, 2019
Platz EA et al. Physical activity and Benign Prostatic Hyperplasia. Arch Intern Med 158: 2349-2356, 1998
Yeh HC et al. Associations of the lower urinary tract symptoms with the lifestyle, prostate volume, and metabolic syndrome in the elderly males. The Aging Male 15(3): 166–172, 2012
Xia BW, Zhao SC, Chen ZP et al. The underlying mechanism of metabolic syndrome on benign prostatic hyperplasia and prostate volume. The Prostate volume 2020: 1–10
Rohrmann S, Giovannucci E, Willett WC, Platz EA. Fruit and vegetable consumption, intake of micronutrients and benign prostatic hyperplasia in US men. American Journal of Clinical Nutrition 85: 523-529, 2007
Suzuki S, Platz EA, Kawachi I, Willett WC, Giovannucci E. Intakes of energy and macronutrients and the risk of benign prostatic hyperplasia. American Journal of Clinical Nutrition 75: 689-697, 2002
Bravi F et al. Macronutrients, fatty acids, cholesterol and risk of Benign Prostatic Hyperplasia. UROLOGY 67: 1205-1211, 2006



