Bacteriële impact op het metabolisme

Robert van Esch MSc.
PsychoNeuroImmunoloog
Vezels behoren tot de belangrijkste voedselcomponenten, daar het grootste deel van de intestinale flora deze verwerkt. Uit de bacteriële fermentatie van deze vezels, de enzymatische voorvertering van macronutriënten en het contact met plantstoffen ontstaan diverse moleculen die door bacteriële flora in de darmen worden geproduceerd.
SCFA
Uit fermentatie van de complexe koolhydraten ontstaan melkzuur en korte ketenvetzuren (SCFA) en gassen, zoals waterstof, koolstofdioxide, methaan en waterstofsulfide. De productie van SCFA bestaat overwegend uit drie metabolieten, namelijk propionzuur of propionaat, boterzuur of butyraat en azijnzuur of acetaat. De meeste anaerobe culturen in de darm produceren acetaat. Propionaat wordt voornamelijk geproduceerd door bacteriën behorende tot de stam der Bacteroidetes, terwijl de productie van butyraat grotendeels voor rekening komt van de stammen Actinobacteria en Firmicutes. De bacteriële productie van SCFA vindt direct plaats uit het beschikbaar komen van pyruvaat en lactaat of indirect met behulp van acetyl-CoA.
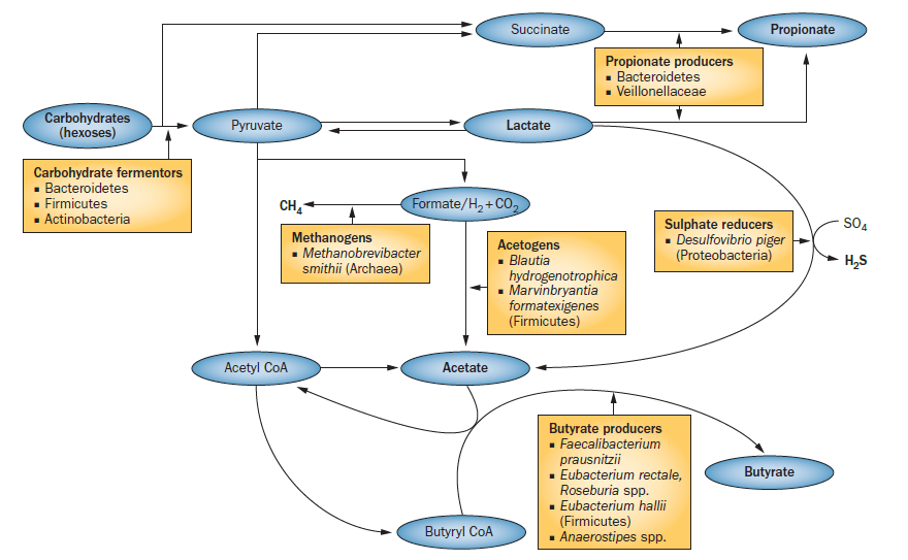
Een groot gedeelte van de SCFA wordt gelijk na productie geabsorbeerd door de epitheelcellen, die de butyraat als brandstof gebruiken voor genexpressie, differentiatie, proliferatie en apoptose. De lever neemt een aanzienlijk deel van de propionaat tot zich voor gluconeogenese en voor de vorming van ketonen. Een klein deel van de SCFA verdwijnt richting perifere weefsels voor de stofwisseling aldaar. Acetaat is het meest voorkomende korte ketenvetzuur in het bloed en speelt in de periferie een hoofdrol als substraat voor vetzuursynthese en cholesterolproductie in de mitochondria.
Een bescheiden deel van de propionaat- en butyraatproductie komt uit voort uit eiwitfermentatie. Eiwitfermentatie vindt vooral plaats in het colon descendens. Teveel eiwitfermentatie en overmatige, intestinale metabolisme van aminozuren kan leiden tot de productie van potentieel schadelijke producten zoals biologische amines en ammoniak. In de darmen worden eiwitten normaliter door spijsverteringsenzymen en door proteases en peptidases afkomstig van bacteriën afgebroken tot peptiden en aminozuren. De meest dominante bacteriegroepen betrokken bij de aminozuurfermentatie zijn de Clostridia, Lactobacillen, Streptococcen en Proteobacteriën.
Mucine
Opvallend is dat mucus eveneens een voedingsbodem kan zijn voor microbiotische culturen. De uit glycanen opgebouwde mucine, die door globletcellen wordt afgegeven, vormt samen met water in de gehele tractus een slijmvlieslaag waarin zich micro-organismen bevinden. Deze mucus bestaat uit twee compartimenten die in het colon een maximale dikte bereiken. De onderlaag is nagenoeg steriel, terwijl de bovenlaag zorgt voor de mogelijkheid tot aanhechting van bacterieculturen. De mucine is grotendeels opgebouwd uit essentiële suikers, zoals galactosamine, galactose en glucosamine, en vormt glycoproteïnen met behulp van bepaalde aminozuren. De capaciteit van darmbacteriën om de essentiële suikers uit mucine als brandstof te kunnen gebruiken wordt bepaald door de aanwezigheid van specifieke verteringsenzymen, die glycosiden en polysacchariden afbreken. Sommige bacteriën zijn in staat sacchariden af te breken, terwijl andere zich alleen richten op de vertering van specifieke glycanen. Zo beschikken Bacteroidetes over meer enzymen die glycanen afbreken dan Firmicutes. De afbraak, modulatie en opbouw van mucine en de integriteit van de epitheelwand staan onder controle van specifieke bacteriegroepen.
Sommige Bacteroides hebben aantoonbare invloed op de coördinatie van de mucusproductie; de Lactobacillus casei is bijvoorbeeld in staat de afbraak van mucine te sturen. De afbraak van mucine staat grotendeels onder controle van de Akkermansia muciniphila. De A.muciniphila functioneert anaeroob en gebruikt mucine als bron voor zijn behoefte aan energie, koolstof en stikstof. Zij vertegenwoordigt tot drie procent van de totale microbiële gemeenschap in de darm en is de meest dominante mucus afbrekende bacteriesoort in het colon. Tevens heeft men vastgesteld dat A.muciniphila behoort tot de belangrijkste producenten van propionaat. Een vetrijk dieet zorgt voor significante daling van de aanwezigheid van A.muciniphila, terwijl natuurlijke prebiotica het tegenovergestelde doen. Een samenwerking tussen bacteriën die mucine kunnen verteren en bacteriën die dat niet kunnen, levert de gegarandeerde beschikbaarheid van brandstof en bouwstenen aan alle lichaamsvriendelijke culturen.
"Een vetrijk dieet zorgt voor significante daling van de aanwezigheid van A.muciniphila, terwijl natuurlijke prebiotica het tegenovergestelde doen"
De fermentatie van resistent zetmeel door Firmicutes waardoor acetaat wordt geproduceerd of de productie van lactaat door melkzuurproducenten, zoals Lactobacilli, levert bijvoorbeeld substraat voor andere bacterieculturen, die het vervolgens omzetten in butyraat. Ook de intestinale aanwezigheid van andere componenten dan suikers kan van invloed zijn op de microbiotische stofwisseling in de darm. Zwavelmetabolieten van organische of lichaamsvreemde oorsprong kunnen bijvoorbeeld bacteriën activeren die zwavel afbreken. Evenzo kunnen specifieke bacteriën galzure zouten verwerken, indien deze niet tijdig worden geresorbeerd. De meeste galzure zouten worden in het ileum geresorbeerd en teruggevoerd naar de lever.
Slechts een klein deel ontsnapt aan de enterohepatische kringloop en komt in het colon terecht. De bacteriële culturen aldaar zijn in staat de structuur en eigenschappen van de galvloeistof te veranderen. Diverse bacteriën, waaronder Bacteroides, Bifidobacterium, Clostridium en Lactobacillus, beschikken over hydrolase-enzymen die deconjugatie van galbestanddelen kunnen laten plaatsvinden, waardoor de toxiciteit van galvloeistof afneemt. De galzure zouten zijn op hun beurt in staat invloed uit te oefenen op de samenstelling van de lokale flora, daar ze voor sommige intestinale micro-organismen toxisch kunnen zijn.
Producenten van cofactoren
Naast leverancier van energiesubstraat is het intestinale microbioom een potentiële producent van functionele hoeveelheden aan cofactoren, die een rol spelen bij de stofwisseling van zowel lichaamsvriendelijke micro-organismen als lichaamscellen. Uit studies bij mensen en dieren is de afgelopen decennia gebleken dat bacteriën in de darm in staat zijn tot de productie van vitamine K2 en B-vitaminen.
In 2015 hebben wetenschappers middels genetisch onderzoek vastgesteld welke micro-organismen welke soort en mate van vitamineproductie voor hun rekening nemen. Sommige van de 256 onderzochte darmbacteriën blijken in hun genoom de informatie te hebben voor de expressie van de biosynthese van acht B-vitaminen, namelijk biotine, cobalamine (B12), folaat, niacine (B3), panthoteenzuur (B5), pyridoxine (B6), riboflavine (B2) en thiamine. Tevens blijken enkele darmbacteriën helemaal niet in staat tot vitamineproductie.
De meest voorkomende productiecapaciteit betreft die voor B2 en B3. Vrijwel alle families van de Bacteroidetes, Fusobacteria en Proteobacteria blijken in staat tot de productie van B2 en biotine, terwijl de potentiële producenten onder de Firmicutes en Actinobacteria respectievelijk slechts de helft en aanzienlijk minder dan de helft betreft. Alle Fusobacteria zijn mogelijke producenten van B12, terwijl dit bij andere stammen beperkt blijft tot minder dan de helft. Onder de Bacteroidetes blijkt meer dan negentig procent een potentiële producent van alle B-vitaminen, uitgezonderd B12. Bij het genetisch onderzoek heeft men ook waargenomen dat sommige organismen elkander genetisch aanvullen, wat mogelijk kan wijzen op cross-feeding of zelfs op afhankelijkheid in het geval van bacteriën die geen potentiële productiecapaciteit bezitten.
Op basis van hun bevindingen schatten de wetenschappers dat de darmbacteriën minstens een kwart van de dagelijkse lichaamsbehoefte aan biotine, B12, folaat en niacine kunnen produceren. Het epitheel van het colon blijkt daarbij in staat via speciale transportmechanismen de absorptie van B-vitaminen te laten plaatsvinden richting de bloedbaan.
Conclusie
De status en samenstelling van de bacteriële flora heeft (in)directe impact op het totale metabolisme.
Vezelfermentatie en contact met voedselcomponenten zorgt in de darm voor de bacteriële productie van metabolieten en andere moleculen, die de stofwisseling buiten de darm kunnen beïnvloeden.
Referenties
Reunanen, J. et al. Akkermansia muciniphila adheres to enterocytes and strengthens the integrity of epithelial cell layer. Appl Environ Microbiol, 2015
1469–1476, 2004


